発生生物学:卵成熟と受精機構
研究内容
生殖は生物の示す最も基本的な現象の一つであり、多くの生物では受精により生殖が行われます。
この受精機構の中で、特に
1.卵はどのようにして精子を受容し発生する能力を獲得するのか(卵成熟機構)、
2.精子はどのような機構により卵内へ侵入するのか(精子侵入機構)、
3.受精する精子はどのように卵を活性化し、発生を開始するのか(受精時の卵活性化機構)
という問題を、細胞及び分子レベルの両面から解析していきます。
これらの問題を解析するための実験材料として腔腸動物、環形動物(ゴカイ類やエラコ)、軟体動物(二枚貝類)、棘皮動物(ウニ、ヒトデ類)、原索動物(単体ホヤ類)を用いています。
主に、シグナル因子に感受性を持った蛍光物質と顕微蛍光測光法を用いて、細胞内のシグナル因子(カルシウムイオン、サイクリックAMPなど)を直接定量することができます。そこで現在、クラゲ、ヒトデ、および二枚貝類の卵母細胞を用いて、卵成熟の再開におけるこれらシグナル因子の役割の解析、及びウニ、ホヤ類を用いた受精時の卵活性化機構の解析、特に卵内カルシウムイオンの上昇を誘起する精子因子の同定を行っています。
最近の研究結果
ヒトデ卵母細胞中の、核内のカルシウムイオン変化を測定する技術を確立し、卵の核内(卵核胞中)カルシウムイオン変化が細胞質中のカルシウムイオン変化とは独立に進行し、また卵成熟の進行とも密接に関連していることを明らかにしました。卵内にはいくつかのカルシウムイオン遊離系が存在しています。これらのカルシウムイオン遊離系が卵成熟過程でどのように機能し、また相互に関連して卵成熟を進行させるのか検討を行っています。
ヒトデ受精時の卵内への精子侵入過程に、マイクロフィラメント系の運動系が機能していることを、マイクロフィラメント系の運動阻害剤 cytochalasin
による受精阻害、及び電子顕微鏡、蛍光 phalloidin を用いた蛍光顕微鏡観察で精子侵入部位にマイクロフィラメントを観察することにより明らかにしました。ヒトデ精子は、受精時に先体反応を起こし、マイクロフィラメントの伸長により先体糸を形成します。卵表の精子侵入部位には受精丘が形成され、受精丘中にもマイクロフィラメントが見られます。そこで、これらのマイクロフィラメントが受精時の精子侵入にどのように機能しているのか明らかにしようとしています。
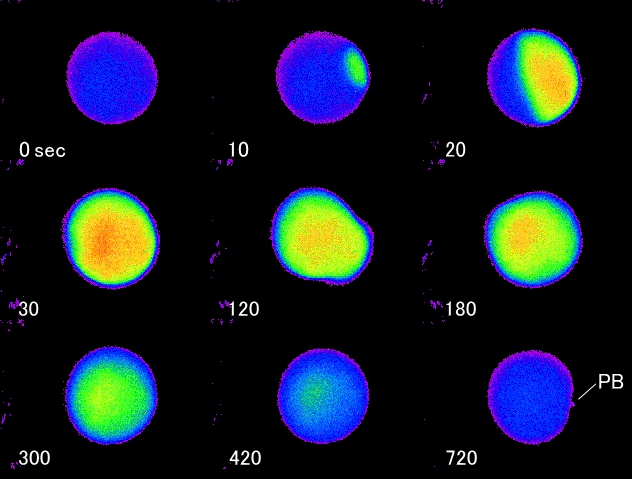
ユウレイボヤの精子から、哺乳類以外では初めて卵を活性化する(卵内カルシウムイオンを上昇させる)因子の抽出に成功しました。哺乳類では、精子もしくは精子の可溶性分画を卵内へ顕微注射すると卵の付活が起こります。哺乳類の卵内カルシウムイオンの上昇は、イノシトール1,4,5-三リン酸によるカルシウム遊離系が作用していると考えられています。一方、海産無脊椎動物卵では、それ以外カルシウム遊離系も機能している可能性が示唆されています。そこで哺乳類以外の受精時の精子による卵内カルシウム遊離機構を解析することで、精子による卵活性化の一般性を検討していきます。左図はユウレイボヤ受精時のカルシウム波の伝搬の様子。ユウレイボヤ卵は第一減数分裂中期で受精し、その直後に精子侵入部位から卵全体にカルシウム波が走る(10,20,30
sec)。受精2~3分で、卵内細胞質の再配置に伴う卵の変形が起こる(120,180 sec)。その後数回のカルシウムオッシレーションを経た後、卵内カルシウムイオンレベルは受精前のそれに戻る(300,420
sec)。受精後約12分で第一極体(上図 720 sec の PB に示した)、30分で第二極体を放出する。
最近の主な発表論文
Doticon_grn_NEW.pngSoluble sperm extract specifically recapitulates the
initial phase of the Ca2+ response in the fertilized oocyte of P. occelata
following a G-protein/ PLCβ signaling pathway.
Nakano T, Kyozuka K.
Zygote. 2014 Oct 16:1-15.
Doticon_grn_NEW.pngIntracellular calcium signaling in the fertilized eggs
of Annelida.
Nakano T, Deguchi R, Kyozuka K.
Biochem Biophys Res Commun. 2014 Aug 1;450(3):1188-94. Review.
Guanine nucleotides in the meiotic maturation of starfish oocytes: regulation
of the actin cytoskeleton and of Ca(2+) signaling.
Kyozuka K, Chun JT, Puppo A, Gragnaniello G, Garante E, Santella L.
PLoS One. 2009 Jul 20;4(7):e6296. PMID:19617909
Nitric oxide (NO) increase at fertilization in sea urchin eggs upregulates
fertilization envelope hardening.
Mohri T, Sokabe M, Kyozuka K.
Dev Biol. 2008 Oct 15;322(2):251-62. Epub 2008 Jul 29. PMID:18694744
Actin cytoskeleton modulates calcium signaling during maturation of starfish
oocytes.
Kyozuka K, Chun JT, Puppo A, Gragnaniello G, Garante E, Santella L.
Dev Biol. 2008 Aug 15;320(2):426-35. Epub 2008 Jun 6. PMID:18599031
Novel two-step Ca2+ increase and its mechanisms and functions at fertilization
in oocytes of the annelidan worm Pseudopotamilla occelata.
Nakano T, Kyozuka K, Deguchi R.
Dev Growth Differ. 2008 Jun;50(5):365-79. Epub 2008 Apr 28. PMID:18445067
Two phases of calcium requirement during starfish meiotic maturation.
Tosuji H, Seki Y, Kyozuka K.
Comp Biochem Physiol A Mol Integr Physiol. 2007 Jun;147(2):432-7. Epub
2007 Jan 30. PMID:17317251
Serotonin stimulates [Ca2+]i elevation in ciliary ectodermal cells of echinoplutei
through a serotonin receptor cell network in the blastocoel.
Katow H, Yaguchi S, Kyozuka K.
J Exp Biol. 2007 Feb;210(Pt 3):403-12. PMID:17234609
Increase in intracellular cAMP is a prerequisite signal for initiation
of physiological oocyte meiotic maturation in the hydrozoan Cytaeis uchidae.
Takeda N, Kyozuka K, Deguchi R.
Dev Biol. 2006 Oct 1;298(1):248-58. Epub 2006 Jun 27. PMID:16884710
Modulation of calcium signalling by the actin-binding protein cofilin.
Nusco GA, Chun JT, Ercolano E, Lim D, Gragnaniello G, Kyozuka K, Santella
L.
Biochem Biophys Res Commun. 2006 Sep 15;348(1):109-14. Epub 2006 Jul 17.
PMID:16875665
NAADP and InsP3 play distinct roles at fertilization in starfish oocytes.
Moccia F, Nusco GA, Lim D, Kyozuka K, Santella L.
Dev Biol. 2006 Jun 1;294(1):24-38. Epub 2006 Mar 20. PMID:16545362
NAADP triggers the fertilization potential in starfish oocytes.
Moccia F, Lim D, Kyozuka K, Santella L.
Cell Calcium. 2004 Dec;36(6):515-24. PMID:15488601
The M-phase-promoting factor modulates the sensitivity of the Ca2+ stores
to inositol 1,4,5-trisphosphate via the actin cytoskeleton.
Lim D, Ercolano E, Kyozuka K, Nusco GA, Moccia F, Lange K, Santella L.
J Biol Chem. 2003 Oct 24;278(43):42505-14. Epub 2003 Jul 16. PMID:12867432
NAADP+ initiates the Ca2+ response during fertilization of starfish oocytes.
Lim D, Kyozuka K, Gragnaniello G, Carafoli E, Santella L.
FASEB J. 2001 Oct;15(12):2257-67.PMID:11641253
Breakdown of cytoskeletal proteins during meiosis of starfish oocytes and
proteolysis induced by calpain.
Santella L, Kyozuka K, Hoving S, Munchbach M, Quadroni M, Dainese P, Zamparelli C, James P,
Carafoli E.
Exp Cell Res. 2000 Aug 25;259(1):117-26. PMID:10942584
Nicotinic acid adenine dinucleotide phosphate-induced Ca(2+) release. Interactions
among distinct Ca(2+) mobilizing mechanisms in starfish oocytes.
Santella L, Kyozuka K, Genazzani AA, De Riso L, Carafoli E.
J Biol Chem. 2000 Mar 24;275(12):8301-6. PMID:10722659
Cortical granule translocation during maturation of starfish oocytes requires
cytoskeletal rearrangement triggered by InsP3-mediated Ca2+ release.
Santella L, De Riso L, Gragnaniello G, Kyozuka K.
Exp Cell Res. 1999 May 1;248(2):567-74. PMID:10222148
Injection of sperm extract mimics spatiotemporal dynamics of Ca2+ responses
and progression of meiosis at fertilization of ascidian oocytes.
Kyozuka K, Deguchi R, Mohri T, Miyazaki S.
Development. 1998 Oct;125(20):4099-105. PMID:9735370