光合成の生理生態学講座
はじめに (200306 30)
温度−光合成曲線の変化 (200306 30)
酵素活性と耐熱性のバランス (200307 07)
葉内CO2濃度 (200307 07)
光合成系タンパク質 (200308 05・14・23 20060817改訂)
低温順化と強光順化は似ている (200309 05 20060817改訂)
Excitation pressure (200309 15)
温度順化とは、生育温度によって光合成特性が変化することを意味します。よく知られているのは、光合成速度の最適温度が生育温度によってシフトすることです。この現象はよく知られている割には意外にメカニズムが明らかではありません。もう一つ、ここ10年ほど着目されているのが、低温での光阻害防御との関連です。この二つの現象はそれぞれ違った生理学的意味を持っています。ここではそれぞれについて私の知っている範囲で書きたいと思います。
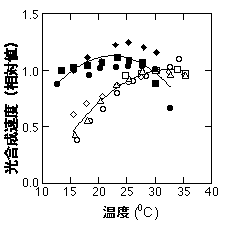
温度−光合成曲線は、こちらで示しましたように上に凸のカーブを描きます。下の図でもわかりますように、同一種であっても温度−光合成曲線は大きく変化します。ほとんどの場合、低温で育てた植物ほど最適温度(光合成速度が最大になる温度)が低温にシフトします。一昔前までは、「温度順化」というとこの温度−光合成曲線の変化を意味していたように思います。

ラカシの光合成速度の温度依存性。白丸は30度で育った葉の、黒丸は15度で育った葉のデータ。それぞれ生育温度での光合成速度を1とした相対値で示している。Hikosaka et al. (1999) を改変。
温度−光合成曲線の変化を最初に報告したのが誰かは私は知りません(Bjorkmanのグループではないかと推察しますが)。多くの情報が蓄積したのは1970年代です。Bjorkmanらのグループが多くの種について温度−光合成曲線を測定した例がBerry and Bjorkman (1980) に示されています。また、Slatyerのグループは異なる標高に分布するEcucalyptus paucifloraのエコタイプについて温度−光合成曲線の変化を(徹底的に)調べています(Slatyer and Morrow 1977, Slatuer and Ferrar 1977a, b, Slatyer 1977a,b)。この他私が知っている範囲では、Chabot and Chabot (1977)、Pearcy (1977)、Lange et al. (1975)、Badger et al. (1982)、Takenaka (1986)、Ferrar et al. (1989)、Hikosaka et al. (1999)、Bunce (2000)、Cunningham and Reid (2002)といった論文があります。これでも氷山の一角でしょう、たぶん。
どのような種でも同じように温度順化を示すわけではないようです。温度−光合成曲線の変化が大きい種としては、砂漠に生育する低木、キョウチクトウ(セイヨウキョウチクトウ・Nerium oleander)とLarrea divaricataがよく研究に使われています(Mooney et al. 1978, Armond et al. 1978, Badger et al. 1982, Ferrar et al. 1989, Hikosaka and Hirose 2001b)。これらの植物は生育温度が20度と45度の葉でそれぞれ最適温度が20度・35度前後になります。Slatyer (1977b) はEcucalyptus paucifloraの生育温度と最適温度の関係を調べています。生育温度と最適温度の間には直線の関係がありますが、生育温度=最適温度ではありません。生育温度が20度だと最適温度も20度になりますが、その他の温度では最適温度の変化は生育温度の変化よりも鈍くなります。つまり、生育温度が10度以下でようやく最適温度が15度に、生育温度が30度を超えると最適温度が20度になります。
温度−光合成曲線が変化することはかなり前から知られていますが、曲線が変化するしくみは意外にわかっていません。全く研究がないわけではなく、いくつかしくみがあることが明らかになっています。しかし、一つのしくみで全ての種の温度−光合成曲線の変化が説明できるわけではないようです。ここではこれまでの研究の概観を書きます。詳細は私のレビュー(Hikosaka et al. 2006)をご覧下さい。
Badger et al. (1982) にまとめられている説です。彼らが使ったのはセイヨウキョウチクトウです。上に書いたようにセイヨウキョウチクトウは温度−光合成曲線の変化が大きく、さらに二次代謝物質(フェノール類)の含有量が少ないので生化学分析がしやすい、というメリットがあります。
彼らはセイヨウキョウチクトウを20度と45度で育成し、20度での光合成速度は20度で育てた植物が(以下LT葉)、45度での光合成速度は45度で育てた植物が(以下HT葉)高いことを確認します。この逆転がどうして起こるのか、その生化学メカニズムを解明しようとしました。
まず20度の光合成速度の違い(LT葉が約2倍高い)を説明するために、光合成関係の酵素の活性などを測定しました。この結果、多くの光合成系タンパク質(RuBPCaseなど多くのカルビンサイクル酵素、電子伝達、ATP合成活性)においてLT葉のほうが高い活性をもっていました。ただし、LTとHTの間で光合成速度は2倍の差があったわけですが、ほとんどの酵素活性には2倍の差はなく、唯一ストロマのFBPase活性にのみ2倍の差が認められました。このことから、彼らはFBPaseが光合成速度(特に高CO2濃度での光合成速度)を律速しているのではないかと考察しています。
次に、高温での光合成速度の違い(HT葉が高い)を説明するために、酵素の耐熱性を比較しました。葉をある温度(例えば45度)に10分置き、置く前と置いた後での酵素活性を比較したところ、いくつかの酵素ではHTとLT葉に違いが見られました。
これらの結果をまとめると、低温で育てた葉は酵素活性が高い(葉の酵素含量が多い)ため低温での光合成速度が高いものの、高温では酵素が失活するため光合成速度が低くなってしまう、ということになります。
低温生育葉で酵素量が多い、という傾向は、詳しくはあとで書きますが、広く見られるようです。また、低温で育てた葉の酵素の耐熱性が低いというのも、一般性があるのだと思われます。したがって、セイヨウキョウチクトウで起こっているような変化は多くの種で起こっていると推察されます。
ただし、この二つだけで最適温度のシフトまで説明できるのかはよくわかりません。例えば、彼らの結果では、LT葉では35度の環境では酵素の失活は起こりませんが、光合成速度を見ると、LT葉のほうが酵素の量が大きいにもかかわらず、HT葉とLT葉には差が見られません。この結果をそのまま信じるならば、LT葉は35度では熱失活意外の要因で光合成速度が下がっていることになります。私もセイヨウキョウチクトウのガス交換を調べたことがありますが、低温で育てた葉のJmaxが35度で相対的に低下しているという結果を得ました(Hikosaka and Hirose 2001b)。これも酵素の熱失活で説明できるのか、それともそれ以外の要因がかかわっているのかはまだわかりません。
「温度と光合成」で書きましたように、光合成速度の温度依存性はCO2濃度によって変わります。Farquhar et al. (1980) は文献値から、Kirschbaum and Farquhar (1980) は実測によって、高CO2濃度ほど最適温度が高くなることを示しています。このため、もし生育温度によって葉内のCO2濃度が変わるのなら、それが温度−光合成曲線に影響している可能性があります。生育温度が気孔コンダクタンスや葉内CO2濃度に及ぼす影響がどれだけよく研究されているのか詳しく知っているわけではありませんが、私の経験では、シラカシ(Hikosaka et al. 1999)、セイヨウキョウチクトウ(Hikosaka and Hirose 2001b)、オオバコ(未発表)いずれも低温で育てた植物で葉内細胞間隙CO2濃度(Ci)が低くなる傾向があります。シラカシでは15度で育てた植物の葉のCiは約230ppm、30度で育てた植物の葉では約300ppmと大きな差があり、最適温度にちょっとだけ(数度)影響を与えていました。
葉内細胞間隙CO2濃度だけではなく、葉緑体内CO2濃度に影響を与えているという指摘もあります。Makino et al. (1994b) はイネを異なる温度で育て、25度での光合成速度を比較しました。するとRuBPCaseあたりの光合成速度は低温で育てた葉で低い、という結果が出ましたが、酵素を単離してみると酵素あたりの活性、activation stateには生育温度の影響はなく、残った可能性として「低温で育てた植物では葉内のCO2拡散が悪く、葉緑体内CO2濃度が低いのではないか」と考察されています。さらにその原因として、低温で育てた植物では葉緑体中にデンプンが蓄積するため、それがCO2の拡散を妨害しているのではないか、と考察されています。ただし、実際に葉緑体CO2濃度が測定されているわけではないので、さらなる研究が必要です。ちなみに、私はセイヨウキョウチクトウでRuBPCaseあたりの光合成速度を比較し、さらにクロロフィル蛍光と光合成速度を同時に測定することで葉緑体CO2濃度の影響の推定もしましたが、低温生育葉と高温生育葉の間に違いは見られませんでした。イネとセイヨウキョウチクトウでは違うことが起こっているようです(Hikosaka and Hirose 2001b)。
CO2濃度を変えて光合成速度の温度依存性を変えると、二つの律速段階の温度依存性を見ることができます(詳しくはこちら)。低CO2濃度で光合成速度を測定すればRuBCaseの、高CO2濃度で光合成速度を測定すればRuBP再生速度の温度依存性を明らかにすることができます。そこから温度順化を見てみましょう。
○RuBPCase
上にも書きましたように、RuBPCaseが律速するときの光合成の温度依存性は複雑なものになります。しかしCiを固定して温度を変え、光合成速度を測定し、違う温度に順化した葉の光合成速度の温度依存性を比較すれば、この酵素が生育温度によって変化したかどうかが推定できるはずです。この解析を最初にやったのはFerrar et al. (1989)で、セイヨウキョウチクトウとユーカリ数種を使っています。彼らは15、25、35度の3点でしか測定していませんが、それでも活性が最大になる温度が生育温度によって変わってしまう種がいくつかあります。以後同様の解析はHikosaka et al. (1999) やBunce (2000) によって行われていますが、やはりRuBPCase活性の温度依存性は生育温度によって変わる、という結果が得られています。詳細な解析はホウレンソウを使ったYamori et al. (2005) によって示されました。我々は最近文献サーベイを行い、生育温度とRuBPCase活性の関係を調べました。Vcmaxの温度依存性を活性化エネルギーとして数値化したところ(詳しくは述べませんが、「Vcmaxの活性化エネルギーが高い」=「Vcmaxと温度の関係が急」=「通常CO2濃度での温度-光合成曲線の最適温度が高温になる」、ということを意味します)、Vcmaxの活性化エネルギーには種間のばらつきがあるものの、全てのケースで生育温度が上がるとVcmaxの活性化エネルギーが上昇しているということを見出しました。
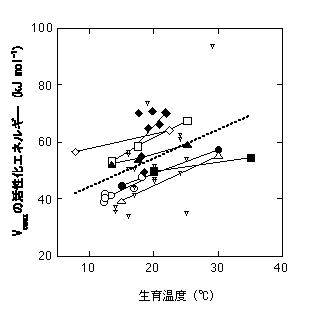
同じシンボルは同一種を示す。ただし、小さい▽はMedlyn et al. 2002 による多種の文献サーベイの結果。太い点線は全体の相関。
単一の酵素であるRuBPCase活性の温度依存性が変わるしくみ、というのはきちんとわかっているわけではありませんが、いくつか可能性が指摘されています。最も重要と考えられるものとして、rubisco activaseという酵素の関与が指摘されています。rubisco activaseはRuBCaseを活性化する酵素です。この酵素は高温で失活しやすく、例えばワタでは35℃程度以上で失活が起こり、温度-光合成曲線に影響します(Crafts-Brandner and Sulvucci 2000)。Salvucci and Crafts-Brandner (2004) はツンドラに生育するいくつかの種では比較的低い温度でrubisco activaseが失活することを見出し、温度-光合成曲線の種間差の原因であることを指摘しています。Yamori et al. (2006) は異なる温度で育てたホウレンソウのRuBPCase活性化率を解析し、低温で育てたホウレンソウは比較的低温でRuBPCaseの不活性化が起こり、光合成の最適温度の低下の原因の一つであることを示しました。一方、rubisco activaseは温度-光合成曲線に影響していない、という見解もあります。Cen and Sage (2005) はサツマイモを使った解析で、RuBPCaseの不活性化はRuBPCaseが光合成を律速していない(他の律速段階が光合成を律速しているとき)のみに起こり、RuBPCaseが律速段階のときは活性化されていると指摘しました。つまりSageの主張は、不活性化は律速段階が変わったことによって引き起こされたものであり、光合成の低下の原因ではない、ということです。
他にも可能性はあります。Yamori et al. (2006) はホウレンソウのRuBPCaseのspecificity factorが生育温度によって変化することを示しています。上記の葉内CO2コンダクタンスが変われば、見かけ上RuBPCase活性の温度依存性が変わります。まだまだ研究が必要なようです。
○RuBP再生過程
RuBP再生過程というのは、RuBP carboxylationによって作られたPGAからRuBPを再生する過程のことで、要するにRuBPCaseが触媒する反応以外の光合成系のことだと考えて間違いありません(RuBPCase触媒過程とRuBP再生過程に分けるというのはRuBPCaseとそれ以外、ということに等しいです)。ですから一言でRuBP再生過程といっても様々な反応を含みます。
高CO2濃度で測定した光合成速度はRuBP再生過程に律速されていると考えられています。また、高CO2濃度では光呼吸の影響が少ないので、光合成速度がそのままRuBP再生能力と比例すると考えることができます。こちらで述べたように光合成速度の最適温度は高CO2濃度で高くなります。これは光呼吸の影響(通常のCO2濃度では高温ほど光呼吸が多いため、低温側に最適温度がある)とRuBP再生能力の最適温度が比較的高いということの両方に由来します。
高CO2濃度で測定した光合成速度の温度依存性も生育温度によって変化します。セイヨウキョウチクトウでは20度で育てた場合、最適温度が35度付近にありますが45度で育てると45度付近になります(Badger et al. 1982)。シラカシでは最適温度がどこにあるかわかりませんでしたが、高温で育てた葉のほうが大きな温度依存性(温度を横軸に、速度を縦軸にとったときに傾きが大きい)を示しました(Hikosaka et al. 1999b)。その他の研究でも最適温度のシフトや温度依存性の変化などが見られています(Ferrar et al. 1989, Bunce 2000, Yamasaki et al. 2002)。
ではRuBP再生過程の温度依存性が変化するメカニズムはなんなのでしょうか。それにはまずRuBP再生速度を決めている要因を知る必要があります。しかしこれがきちんとはわかっていません。通説ではRuBP再生速度を律速しているのは電子伝達系だとされています。その根拠の一つとしてKirschbaum and Farqihar (1984) がガス交換によって得られたRuBP再生速度の温度依存性と、チラコイド膜を単離して得た電子伝達速度の温度依存性がよく似ていることを示したことが挙げられます。しかしこの研究ではRuBP再生速度と電子伝達速度が別の種で得られているので、正当な根拠とは言えません。こちらでも指摘したように、電子伝達速度の温度依存性には明らかに種間差があるからです。また、Badger et al. (1982) は電子伝達速度の温度依存性と高CO2濃度での光合成速度の温度依存性が違う(前者の最適温度は生育温度の影響を受けないが、後者の最適温度は生育温度によって変化する)ことを示しています。さらに彼らは低温で測定した光合成速度とFBPase活性の間に相関が見られたとして、RuBP再生過程の律速段階がFBPaseかもしれないと示唆しています。一方、Yamasaki et al. (2002) では異なる生育温度で育成したコムギではRuBP再生と電子伝達の温度依存性がほぼ一致していることを示しています。この点は研究する余地がかなりありそうです。
というわけで律速段階がどこかがわかっていないのに温度依存性のメカニズムが明らかになっているわけはありません。ただ、電子伝達系については比較的研究が多いので、それを紹介することにしましょう。
チラコイド膜を単離し、メチルビオロゲンなどの酸化剤を加えると電子伝達活性を測定することができます(Hill活性という)。その温度依存性も生育温度によって変化します。私が知っている中ではArmond et al. (1978) が古いですが、もっと前から調べられているだろうと思います。面白いのは、電子伝達の最適温度は変わるとは限らないということです(Armond et al. 1978, Badger et al. 1982, Mitchell and Barber1986)。しかし、最適温度より低い温度での温度依存性が変化し、低温で育てた葉の依存性が小さいという傾向が見られます(Armond et al. 1978, Badger et al. 1982, Mitchell and Barber1986)。ただし、Yamasaki et al. (2002) では電子伝達活性の最適温度がきれいに変わっている例が見られます。Yamasaki et al. (2002) ではさらに電子伝達系を解析し、光化学系II周辺の電子伝達活性の変化が最適温度変化の原因であることを示しました。Yamasaki et al. (2002) の結果はたいへんきれいですが、他の種の傾向をどこまで説明できるかはよくわかりません。種によって生育温度応答もそのメカニズムも違うのではないかと思われます。
○部分反応間のバランス変化
光合成は様々な反応から成り立ちますが、各反応の温度依存性は違います。このため、どの反応が光合成速度を律速しているかで光合成速度の温度依存性が変化することが予想できます。さらに、温度によって律速段階が違う状況、というのを想像してみましょう。
話を簡単にするために、光合成速度が二つの部分反応A・Bから成り立っているとしましょう(下図)。部分反応Aは最適温度が低く、部分反応Bは最適温度が高いとします。光合成速度は両者の速度のうち低い方となります(太線)。低温で光合成を高くしたい場合は、低温で効率の悪い反応の活性を高めれば光合成の最適温度も低くなります(左)。逆に高温で光合成を高くしたい場合は高温で効率の悪い反応の活性を高めればいいわけです(右)。
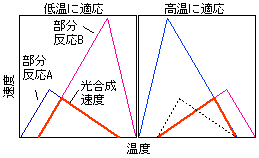
ここで考えているのは、光合成系内のタンパク質分配(窒素分配)です。ある反応の効率を上げるためには、その反応を担うタンパク質の量を増やしてやらなければいけません。しかし葉が持てるタンパク質の量は有限です。そこで効率を上げるためには、非効率なほうの反応に多く窒素を投資し、二つの部分反応のバランスを保つ必要があります。さらにそのバランスをうまく変えてやれば温度−光合成曲線の形の変化も説明できるだろう、ということです。
このもともとのアイディアはFarquhar and von Caemmerer (1982) にちょっとだけ示されたのが最初です。このアイディアを、タンパク質のコストも考慮に入れた上で詳細に検討したのがHikosaka (1997) です。この論文はHikosaka and Terashima (1995) で提示した光合成系のタンパク質分配モデルをさらに発展させ、各反応の温度依存性を取り込んだものです。このモデルでは強光下の光合成速度の律速段階(上の例でいう部分反応AとB)をRuBPCaseとRuBP再生反応としています。部分反応の温度依存性は主に文献サーベイによって得ています(こちらに使用例を示しました)。このときの文献サーベイでわかったことが、種によって電子伝達活性の温度依存性が違うことです。これはシミュレーション結果に大きな影響を及ぼします。RuBPCase活性の温度依存性と電子伝達活性の温度依存性が似ていれば、タンパク質分配を変えても光合成速度の温度依存性は変わらず、温度順化におけるタンパク質分配の変化に意味はありません。しかし、二つの部分反応の温度依存性が変われば上の図で示したような効果が期待でき、温度によって分配を変えたほうが効率が上がる、ということが予測されました。
ではこの予測はどの程度正しいか、というと、正しい場合もあり、正しくない場合もあり、という感じです。Hikosaka et al. (1999) では常緑広葉樹シラカシを使い、部分反応のバランスが変わることを見出しました。イタドリ(Onoda et al. 2005a)やオオバコ(Hikosaka 2005)でも同様の変化が得られています。一方、Bunce (2000) は5種の一年草を使って、VcmaxとJmaxの間のバランスが生育温度によって変わらないことを示しています。さらに、Medlyn et al. (2002) もマツの仲間Pinus pinasterで変化しないことを示しています。私もセイヨウキョウチクトウ(Hikosaka and Hirose 2001b)、ブナ(Onoda et al. 2005b)、イネ(Borjigidai et al. 2006)で変わらないことを示しました。未発表ですが、異なる緯度から得られたオオバコを比べると、変化するものと変化しないものがあり、ケースバイケースのようです。
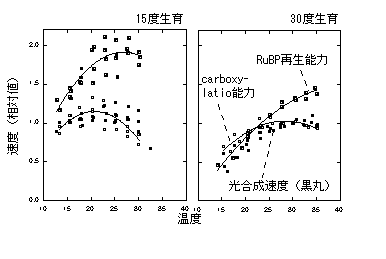
分配が変化することによって光合成の温度依存性が変化します。下はシラカシの例です。低温で育てた場合は光合成は全ての葉温でRuBPCase律速ですが、高温で育てた場合は、23℃以下でRuBP再生が律速し、23℃以上ではRuBPCaseが律速します(carboxylation能力)。このように、バランス変化によって低温での光合成速度の律速段階が変化します。同様の結果はイタドリでも得られています(Onoda et al. 2005b)。ただ、Hikosaka (1997) が予測したような、バランス変化によって最適温度が変化した例は今のところありません。
Badger et al. (1982) の説明で、低温生育葉の光合成系タンパク質の活性が高い、という話を書きました。このような変化は多くの種で見られており、比較的普遍性は高いようです。
光合成系タンパク質の変化は光順化においてよく観察されます。光合成系における光順化と温度順化を比較すると、多くの共通点があることが知られています。ざっと挙げると、低温で生育した葉、あるいは低温環境に数日さらした葉では、RuBPCaseを含む多くのカルビンサイクルの酵素活性の上昇(Holaday et al. 1992, Hurry et al. 1995, Strand et al. 1999)、糖代謝酵素活性(細胞質のショ糖リン酸合成酵素やFBPase)の上昇(Martindale and Leegood 1997, Strand et al. 1999)、chl a/b比の上昇(文献失念)、光合成能力の上昇などです。これらの変化は強光順化で見ることができます。アオキやオオバコで強光順化と低温順化の比較をしましたので、興味がある方はご覧下さい(Muller et al. 2005, Hikosaka 2005)。
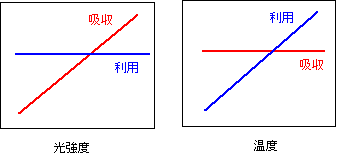
このような類似点にどのような意義があるのかは、光エネルギーの「吸収」と「利用」のバランスを考えると理解することができます(Huner et al. 1998)。光合成系をエネルギー利用の面から考えると、光を吸収し、化学エネルギーに変換する系である光化学系と、そのエネルギーを利用してCO2を固定するためにはたらくその他の系(電子伝達・ATP合成・カルビンサイクル)の二つに分けることができます。前者を「吸収系」、後者を「利用系」と呼ぶことにしましょう。吸収系と利用系の活性が環境によってどのように変化するのかを考えてみましょう。
まず、光の吸収量(吸収速度)は光環境に強く依存します。強光ほど吸収する光量は多くなります。一方、吸収量は温度にはほとんど依存しません。光化学反応はごく低温でも秒未満の速度で起こります。これに対し、利用系の能力は光環境に依存しません(光が足りないと不活性化する酵素もありますが、光エネルギーを直接使っているわけではありません)。しかし、利用系のタンパク質活性は温度に強く依存し、低温ほど低い傾向があります。ここで強光環境と低温環境の「吸収」と「利用」のバランスを考えてみて下さい。強光環境では利用系の能力に比べ吸収系の能力が上がります。低温では、吸収系の能力に比べ利用系の能力が下がります。つまり、両者には、「相対的に、吸収系の能力に比べて利用系の能力が低い」という共通点があります(下図)。吸収に対して利用能力が低い、ということは、光合成系に利用しきれない過剰エネルギーがたまってしまうことを意味します。この状態が長く続けば光阻害などの傷害が起こりやすくなると考えられます。この状態を回避するためにはどうしたらよいでしょうか。答えは、低温や強光で利用系にかかわるタンパク質の量を増やし、エネルギー利用能力を上げる、ということです。
植物が実際に吸収と利用のバランスを変えている、ということはSteffen et al. (1995)の実験できれいに示されています。彼らはジャガイモを異なる温度で育成しました。葉面積あたりのクロロフィル含量は低温で低くなりました。クロロフィルが光吸収能力を表すと考えれば、低温でクロロフィル含量を下げるのは吸収能力を相対的に下げたと考えられます。生育温度で測定した光合成速度は高温生育ほど高い傾向にありましたが、20度で測定した最大光合成速度は低温生育葉ほど高いという結果が得られました。これは、低温生育葉で酵素量が増えた結果と考えられます。そしてクロロフィルあたりの光合成速度を生育温度で測定すると、この値は生育温度によらず一定の値を示しました。つまり吸収能力と利用能力の関係が比較的一定に保たれていることを示唆しています。
ちなみに、このような光の吸収と利用のバランス変化は、最適な光合成系タンパク質分配でも予測することができます。上述の窒素分配モデルでは、窒素あたりのクロロフィルが低温ほど低くなることを示しています(Hikosaka 1997)。ほとんどdiscussionしてませんけど。
低温と強光の影響が似ていることから注目されているのがexcitation pressuire(励起圧)です。excitation pressuireはこちらのページで少し説明していますが、数式としては以下のように導かれます。
excitation pressuire=1-qP
ここでqPはnon-photochemical quenchingと呼ばれます。また、この値は近似的に「開いているPSII」の割合と見なすことができます。つまり、1-qPは「閉じているPSIIの割合」ということになります。ここでは「開いている」「閉じている」が重要です。
開いている・閉じている、というのは、光化学系II内における電子受容体、つまりフェオフィチンやQAの酸化還元状態を意味します(光化学系IIの電子伝達についてはこちら)。QAは暗黒下では電子を持っていません。ここで光化学反応が起こり、P680からの電子伝達が起こるとQAが電子を持つことになります。通常QAは電子をQBに渡し、電子伝達が起こります。ここで、QAが電子を持っていない、つまり酸化状態にあることを「開いている」(open)、電子をもっている、つまり還元状態にあることを「閉じている」(closed)と表現します。qPというのは、総PSIIに対する開いているPSIIの割合を示すわけです。
さて、低温・強光の話に戻りましょう。低温・強光の場合、光化学反応に対し酵素反応の進み方が相対的に遅くなります。カルビンサイクル酵素の能力の相対的な低下が起こると、中間代謝産物が蓄積するようになります。電子伝達系では、弱光では各コンポーネントは酸化還元を繰り返し電子を伝達しますが、下流の反応が滞ると、還元されたコンポーネント(具体的には還元型プラストキノンなど)が酸化されずに蓄積されるようになります。そうして下流がつまる(閉じる)と、QAも還元されたまま(閉じたまま)になってしまいます。excitation pressuireの大きさは閉じたQAの割合を表しますから、excitation pressuireが大きいほど下流がつまっている、「吸収」と「利用」のバランスが悪いことを表現していると考えられるわけです。実際、低温に数日順化した植物でexcitation pressuireが低下することが観察されています(Oquist and Huner 1993など多数)。
Excitation pressuireが注目される理由はもう一つあります。それは順化における環境センサの役割を果たしているのではないか、ということです(Huner et al. 1996, 1998)。植物はファイトクロムやクリプロクロムなどいくつか光環境を感じるためのセンサを持っています。しかし、光順化にかかわる色素などは知られておらず、植物がどのようにして光環境を感じているかは明らかになっていません。サイトカイニンや糖濃度などいくつか仮説があるのですが(Ono et al. 2001)、有力候補の一つとしてexcitation pressureが挙げられています。つまり植物は光環境そのものを感じているのではなく、電子伝達のつまり具合の環境の指標として光合成系を変化させているのではないか、ということです。この説を支持するものとして、光合成系のタンパク質のmRNAの発現量が、光や温度そのものよりもexcitation pressureと相関がある、という結果が示されています(Huner et al. 1998)。