光合成の生理生態学講座
はじめに(199909 14)
クロロフィル蛍光とは何か(199909 14)
クロロフィル蛍光の性質(199909 14)
クロロフィル蛍光の測定(19909 22)
クロロフィル蛍光強度の変化(199910 12)
2 非定常状態(199911 08)
Quenchingの定量化(199911 15)
クロロフィル蛍光から何がわかるか(199911 25)
2 電子伝達速度(199912 03)
クロロフィル蛍光利用における注意点(199912 13)
Waltz社のPAMシリーズが販売されて以来、誰でもクロロフィル蛍光の測定できる時代になりました(お金が必要ですが)。生態学会でもPAMを用いた研究の発表が多くなり、「Fv/Fm?、ETR?、何だそれ?」と思った方も多いでしょう。私も1992年くらいまではそうでした。ここでは、クロロフィル蛍光の原理と、クロロフィル蛍光を測ると何がわかるかと、どこに限界(問題)があるか、について書きたいと思います。
ただ、あらかじめ書いておきますが、クロロフィル蛍光そのものについては私も大した知識はありません。我々の分野での利用に必要な知識がある程度です。また、ここに書いてあることはだいたいSchreiber et al. (1994) に書いてありますので、ちゃんと勉強したい方はこちらをどうぞ。また、クロロフィル蛍光そのものの勉強をしたい方は、Krauze and Weis (1991) のレビューをご覧下さい。
なお、この文章を読むためには光化学系IIの構造と機能についてある程度の知識が必要です。こちらをご覧下さい。また、この項に書いてあることは感覚的に理解することを目的としており、必ずしも正確ではありません。正確な説明(そのかわり数式が入る)をこちらに書きました。実際に使用する方は目を通しておいたほうが良いでしょう。
クロロフィルは光を吸収するのが仕事です。吸収した光によって励起され、そのエネルギーを最終的には反応中心に伝えます。このエネルギーは主に電子伝達、最終的には二酸化炭素固定に使われるわけですが、弱光時を除き、全ての光エネルギーを二酸化炭素固定に使えるわけではありません。使われなかったエネルギーはたいていは熱として放散されます。その他、ごくわずかなエネルギーは光として放出されます。このとき放出される光がクロロフィル蛍光と呼ばれています。クロロフィル蛍光として放出されるエネルギーは、吸収エネルギーの0.5から3%程度といわれており、エネルギー収支の点から見ると無視できるレベルのようです。
クロロフィル蛍光を発するのは、基本的には光化学系IIに結合しているクロロフィルのみです。光化学系Iに結合しているクロロフィルは通常条件では蛍光が微弱で、ほとんど無視できるようですが、なぜか液体窒素温度(-198度)まで冷やすと蛍光がかなり強くなります。この蛍光は730nmくらいにピークがあるスペクトルを持ちます。一方、光化学系IIクロロフィルは室温・液体窒素温度どちらでも680nm前後にピークがある蛍光を出します。
光化学系IIクロロフィルの蛍光の大きな、そして有用たらしめている特徴は、吸収エネルギーの「行き先」の変化をクロロフィル蛍光が反映することです。いったん光がクロロフィルに吸収されると、そのエネルギーはA)光化学系IIの光化学反応に利用される、B)熱となって放散される、C)蛍光として放散される、D)光化学系Iの光化学反応に利用される、のいずれかになります(とりあえずここではDは無視します)。光合成が行えるような条件では、多くのエネルギーは光化学反応に流れます。しかし、何らかの原因で光合成が行えない条件になれば、エネルギーは熱、あるいは蛍光に多く流れることになります。このため、蛍光強度が高くなります。また、熱放散されるエネルギーの割合が増えると、蛍光強度が下がります。これをクエンチング(quenching)といいます。non-photochemical quenchingというのは、熱放散が多くなることによる蛍光強度の低下です。一方、photochemical quenchingというのは、光合成系のタンパク質が活性化され、光化学反応に流れるエネルギーが多くなることによる蛍光強度の低下を言います。
蛍光強度が変化した場合、それだけでは熱にエネルギーが行ったのか、光化学反応にエネルギーが行ったのかは区別できません。しかし、光化学反応のエネルギー消費はある方法で知ることができます。それは、短時間の強い光(flash)を当てることです。非常に強い光を当てると、光化学系IIの反応中心から電子を受け取る受容体(フェオフィチン・QA)を全て電子を持った状態(還元状態)にすることができます。この状態では、それ以上強い光をあてても電子を伝達することができず、光化学反応を行うことができません。したがって、エネルギーは全て蛍光か熱放散に流れます。フラッシュを当てている状態と当てていない状態の比較によって光化学反応に流れているエネルギーの割合を見積もることができるわけです。
QAなどの電子受容体が電子をもっていない状態(酸化されている)を、「電子を受け取ることができる」という意味で、「開いている」「open」な状態と呼びます。QAがすでに電子をもっていて、それ以上電子を受け取ることができない場合、「閉じている」「closed」な状態と呼びます。
では、これらの性質を利用することにより、クロロフィル蛍光から何がわかるかを次項で見てみましょう。
っと、その前に、機械について少し説明しておきましょう。
PAM法が開発されるまでは、野外で蛍光収率を測定するなどということは不可能に近いことでした。それは二つの理由によります。一つは、蛍光以外の光と蛍光を分離することが難しいことです。上にも書いたように、クロロフィル蛍光は680nmにピークを持ちますが、このような光は野外に普通にあるものです。太陽光を葉に当てれば、その5-10%程度は反射されてしまい、その光は680nmの光も含んでいます。古くは、材料を暗室に置き、赤い光をカットした光を当てることで蛍光の光を感知できるようにしていたようです。二つめの問題は、蛍光収率を知ることの難しさです。上に書いた「蛍光の変化」というのはあくまで収率(吸収光エネルギーあたりの蛍光放射エネルギー)であり、蛍光強度ではありません。例えば、後で述べるように、蛍光測定では瞬間的な強い光(flash)を当てるということがよく用いられます。瞬間的に強い光を当てると、蛍光強度も上がります。吸収光量が増えるためです。原理的には当てた光あたりの蛍光強度を計算すれば蛍光収率が計算できるわけですが、flashを当てる前と当てている間の照射光強度は数千倍違うこともあります。これを精度良く測定するのは難しいことです。
このような問題点を一気に解決したのがPAM法です。PAMというのはPulse Amplitude Modulationの略で、日本語だとパルス変調とか訳してますかね。残念ながら私はこの手法の原理をほとんど理解していないのですが、私が理解している範囲でいうと、蛍光を誘導するためにある特定の光を当てます(measuring beam)。この光は「パルス変調」されています(ここの意味がわからん。ある周期で強度が変化する光らしいのですが)。この光を当てられて発せられる蛍光は、当てた光同様に「パルス変調」されています。葉からくるいろいろな光のうち、パルス変調されたもののみを感知・測定することにより、反射光などの他の光や、他の光によって励起された蛍光から、measuring beamによって引き起こされた蛍光のみを分離できるわけです。
この手法はU. SchreiberとWaltz社の共同開発によって編み出されたもののようです。現在普及しているクロロフィル蛍光測定装置は、もともとはWaltz社がPAMシリーズとして開発したものが最初で、現在では他にもいくつかの会社で製造・販売されています。
このページではPAMを用いたクロロフィル蛍光測定法のみについて書きます。私は他の手法を使ったことがないためです。
PAMによるクロロフィル蛍光測定の場合、3種類の光をサンプルに当てることになります。
まず、measuring beam(測定光)です。これは、上述のように、パルス変調された蛍光誘導のための光です。光合成の性質に影響を与えないよう、微弱な光強度を使うのが一般的です。蛍光強度は、測定条件が同じならば、当てた光の強度に比例します。したがって、measuring beamを強くすると、機械が拾う蛍光強度が上がることになります。
2つめは、flash(閃光)です。これは、瞬間的に光化学系IIの電子受容体(以下QA)を全て還元するための光で、数千umol quanta m-2 s-1のかなり強い光です。QAが還元されるとそれ以上強い光を当てても光化学反応は起こりませんので、光化学反応以外へのエネルギーの分配を見ることができます。なお、flashの光強度が弱いと、全てのQAを還元できなくなりますので、蛍光強度が見かけ上低くなります。また、flashは0.1秒程度の短い時間である必要があります。しかし、あまり短いと、全てのQAを還元できないので、現実は短ければいいというものでもありません。
3つめは、actinic lightです。適した訳がないのですが、私は照射光と呼んでいます。例えば、100 umol quanta m-2 s-1の強度の光が当たっているときの蛍光強度を知りたい、というときの、「100 umol quanta m-2 s-1の強度の光」がactinic lightだと思って下さい。
ここで注意していただきたいのは、measuring beam, flash, actinic lightいずれを当てても蛍光は出ること、しかし、PAMシリーズが感知する蛍光は、measuring beamによって励起された分のみである、ということです。繰り返しになりますが、measuring beamによって励起された分の蛍光のみを測ることができるようになったことがPAMの優れた点なわけです。
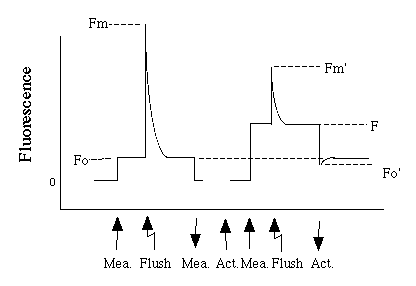
では、クロロフィル蛍光を実際に測ってみましょう。まずは下図をごらん下さい。縦軸はmeasuring beamによって誘導された蛍光の強度で、measuring beam の強度が一定ならば蛍光収率(吸収光エネルギーあたりの蛍光放射エネルギー)に相当します、横軸は時間だと思って下さい。

左側の線は、真っ暗なところに置かれた葉のデータです。まず、何も光を当てていないときは当然蛍光はでません。Measuring beam (Mea.) を当ててみましょう。ちょっと蛍光がでます。この、真っ暗な状態で(実際にはmeasuring beamが当たっているんですが)の蛍光の値をFoと呼びます。ここで、flashを焚きます。すると、QAが還元され、蛍光収率が上がります(flashによって誘導された蛍光を見ているわけではないことに注意)。このときの蛍光の値をFmと呼びます。flashが消えると、蛍光収率も元に戻ります。
このときの蛍光収率の変化はどう理解すべきでしょうか? まず、一度上でも述べたことですが、直観的な説明をしましょう。暗い状態では、当てた光のほとんどが光化学反応に利用されます。したがって蛍光収率は低いです。しかし、flashを焚くと、光化学系はclosedになり、光化学反応が起こらなくなります。これで行き所のなくなったエネルギーが蛍光となり、蛍光収率が上がるわけです。
次に、これを数式を使って論理的に理解しましょう。入射光をI、光化学系・熱放散・蛍光に流れたエネルギーをそれぞれA・B・Cとしましょう。F=Cなわけですが、入射したエネルギーはABCいずれかの方法で消費されるわけで、I = A+B+Cになります。これを入れると、まず、光が当たっていないときの蛍光収率Foは、光化学反応が充分働きますから、
Fo = I C/(Amax+B+C)
Amaxは光化学反応による消費の最大速度です。しかし、flashを焚くと、QAが還元され、measuring beamは光化学反応で消費されなくなります。ので、Fmは
Fm = I C/(B+C)
となります。Bがflashが当たろうが当たるまいが変わらないと仮定すると、葉に光が当たっていないときの量子収率(当たった光のうちどれだけを光化学反応に利用できたか)Amax/Iはこの二つの式から導くことができます。
Amax/I = Amax/(Amax+B+C) = <中略> = (Fm - Fo)/Fm = Fv/Fm
ということで、Fm-FoをFvと定義すると、Fv/Fmによって量子収率を導くことができます。全てのエネルギーが光化学反応に使われる場合は、Amax/(Amax+0+0) =1ということで、Fv/Fmは1になります。しかし、実際の植物では最大値は0.8-0.83くらいの値をとります。暗黒下でも熱放散が若干起こっているためです。
なお、以上の式での説明はかなり概念的なものと考えて下さい。正しい説明はこちらに譲ります。また、以上の式で使っている「量子収率」はエネルギーベース、つまり、当てた「エネルギー」のうちどれだけが光化学反応に使われたかを表します。一方、ここ以外で使っている「量子収率」は当てた「光量子」のうちどれだけが光化学反応に使われたかを表します。一つの光量子が持つエネルギーは波長によって違います(青色はエネルギーが高く、赤色は低い)ので、「量子収率」の意味はエネルギーベースか光量子ベースかで違います。
次に、図の右側の線を見て下さい。これは、actinic light が当たっている状態の葉のデータです。数分以前からactinic light が当たっており、光合成系は定常状態にあると考えて下さい。ここでmeasuring beam を当てると、蛍光収率が上がります。ここで注意していただきたいのは、このときの蛍光収率(Fといいます)はFoよりも高いことです。Fの値は当てるactinic light の強さによって変化します(詳しくは後述)。ここでflashを焚いてみましょう。蛍光強度は上がりますが、Fmほどは上がりません。このときの蛍光強度をFm'と呼びます。flashが消えると蛍光は再びFに戻ります。次に、actinic light を消してみましょう。蛍光強度は大きく減少します。一瞬だけFoよりも下がります(Fo')が、徐々に高くなり、Foと同じ値になります。
では、一部繰り返しになりますが、それぞれの蛍光強度変化の原因を説明しましょう。
○真っ暗なところに置かれた葉の蛍光収率が、flashを焚くことにより上がること(Fo→Fm)は、光化学反応にどれだけエネルギーが流れるか否か、つまり、QAが還元されているか否かの違いを反映しています。flashを焚くと、光化学反応が起こらなくなるため、蛍光にエネルギーが流れ、蛍光収率が上がるわけです。
○真っ暗なところに置かれた葉の蛍光強度と、actinic lightが当たっているときの蛍光収率の違い(FoとFの違い)は、ほとんどはactinic light によって一部の光化学系IIが閉じていることによる蛍光収率の増大で説明できます。ただし、non-photochemichal quenchingも働いています。non-photochemical quenchingについては次をご覧下さい。
○真っ暗なところに置かれた葉にflashを当てたときの蛍光収率と、actinic lightが当たっているときにflashを当てたときの蛍光収率の違いの違い(FmとFm'の違い)は、non-photochemical quenchingで説明されます。一般に、熱放散機構は暗黒化ではあまり働かず、光を当てると働くようになります。したがって、暗黒下よりも、Actinic light が当たっているときに、クロロフィルが吸収した光エネルギーのうち、熱放散に回される割合が多くなります。この変化により、全ての光化学系IIが閉じているときでも蛍光収率が下がります。
○actinic lightが当たっているときの蛍光強度と、actinic lightとflashを当てたときの蛍光強度の違いの違い(FとFm')は、photochemical quenchingで説明されます。多くの場合、actinic light は全ての光化学系IIを閉じるだけの強さがありません。常に何割かの光化学系IIは開いている状態にあります。このためFは常にFm'よりも低くなります。もしactinic light がかなり強く、全ての光化学系IIを閉じることができるようになれば、FとFm'の差はなくなります。
○真っ暗なところに置かれた葉の蛍光強度とactinic light を消した直後の光強度の違い(FoとFo')は、non-photochemical quenching で説明されます。光を消すと直ちに光化学反応は止まりますが、熱放散はまだ起こっているため、エネルギーが消費され、その分Fo'はFoより低くなります。熱放散は消光とともに徐々に不活性化するので、それにつれて徐々にFo'からFoに戻る戻ります。なお、一般に、Fo'を測定するときには赤外光を照射します。赤外光は光化学系IIは吸収せず、光化学系Iのみが吸収することができます。actinic lightを消したあとで赤外光を当てると、光化学系IIよりも後ろの部分の電子伝達を進めることができます。これはなんのためにするかというと、QAを素早く酸化するためです。actinic lightを消しても、電子伝達が滞ってしまえばQAは還元されたままである可能性があります。Fo'を測るときはQAは全ての酸化されている必要があります。これはqNなどのパラメータを計算するときの前提でもあります。
あえて非定常状態の蛍光変化を説明する必要はないんですが、これを説明すると理解しやすいかと思いますので書いておきます。
非定常状態といってもいろいろありますが、ここでは、暗黒下に放置しておいた葉に、ある程度の強さのactinic lightを当てた後の変化の話をします。下の図をご覧下さい。これも模式図です。横軸はフルスケールが7・8分です。
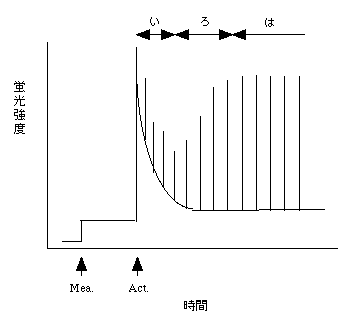
ここでは、actinic light を当て初めてから、一定間隔でflashを焚いています。スパイクはflashによるものだと考えて下さい。まずは、flashを焚いているときの蛍光収率(Fm、スパイクの針の先端の高さ)から見ていきましょう。
まずFmは、actinic light照射後に大きく増加します。これは、光化学反応が行えなくなったための蛍光収率の上昇です。
その後、いったんFmは減少します(図中い)。これはnon-photochemical quenching が大きくなるためです。
その後今度はFm大きくなっていきます(図中ろ)。Fmが大きくなるのは、non-photochemical quenching が減るためです。non-photochemical quenching の大きさは、チラコイド膜内外のpHの勾配の大きさと比例すると言われています。暗黒化では多くの光合成タンパク質が不活性化していて、光照射と同時に活性化が始まります。チラコイド膜の電子伝達系タンパク質は比較的早く活性化されます。しかし、カルビンサイクルの酵素はなかなか活性化されません。電子伝達でプロトン輸送が起こりpH勾配ができますが、pH勾配によってできたエネルギー(ATP)を利用する先がないので、エネルギーが溜まって勾配は大きくなり、non-photochemical quenching もどんどん大きくなります(図中いの時期にあたります)。しかし、カルビンサイクルの酵素が遅ればせながら活性化され、エネルギーを消費するようになると、pH勾配がやや小さくなります。このためFmが上昇します(図中ろ)。そして、その後安定します(図中は)。
次に、Fを見てみましょう。照射直後にFが上がりますが、その後Fm同様下がります(図中い)。ただし、Fの減少がFmの減少よりも大きくなります。これは、光合成系のタンパク質が光活性化されはじめ、下流の電子伝達が活発になり、QAから電子が逃げていくようになり、actinic lightだけでは全ての光化学系IIのQAを飽和させられなくなるためです。その後Fmは大きくなりますが、Fは下がるか安定してしまいます(図中ろ)。ここの挙動はやや複雑です。光合成系タンパク質はどんどん活性化されるので、photochemical quenching は大きくなる一方です。ただし、上述のようにnon-photochemical quenching は上がってまたちょっと下がる、という変化をし、これもFには影響を与えます。図中ろの時期のphotochemical quenching の上昇とnon-photochemical quenching の減少は、だいたい同じ程度で、そのためFは安定、もしくは微減少にしか見えないようです。
ここまで、non-photochemical quenchingとphotochemical quenchingについて書いてきました。これらのパラメータは以下の式によって定量化されています。
qP = (Fm' - F)/(Fm' - Fo')
qN = 1 - (Fm' - Fo')/(Fm - Fo)
両パラメータはquenching coefficientと呼ばれているようです。qPがphotochemical quenching、qNがnon-photochemical quenchingのcoefficientです。どちらも0以上1以下の値になります。
どうしてこういう式になるか、の感覚的な説明をしましょう(正しい説明はこちら)。まずqPについてですが、こちらは簡単です。分母Fm' - Fo'はフラッシュを当てたときの蛍光とフラッシュ・actinic lightを消したときの蛍光の差です。これは、全ての光化学系IIを閉じた状態にしたときの蛍光収率と全て開いた状態にしたときの蛍光収率の差ということで、この大きさが光化学系IIの総量を表します。一方、分子Fm' - Fはフラッシュを当てたときの蛍光収率と当ててないときの蛍光収率の差です。これは、全ての光化学系IIが閉じたときの蛍光強度と、actinic lightを当てているときの蛍光強度の差です。actinic lightをあてているときの蛍光強度は閉じた光化学系IIの数を反映していると考えられますので、Fm' - Fはactinic lightが当たっているときに開いた光化学系IIの数を反映します。ようするに、qPは全ての光化学系IIの数で開いている光化学系IIの数を割っているわけで、「開いている光化学系IIの割合」を示していると考えられています。
光阻害の研究では、1-qPをexcitation pressure(励起圧とでも訳すのでしょうか)と呼んで重要なパラメータとしています。これは「閉じているPSIIの割合」を示しています。このパラメータが大きいと光阻害が起きやすいと考えているようです。こちらにちょっと書きました。
qNはちょっと複雑ですが、そんなに難しいわけでもありません。分母(Fm - Fo)は、actinic lightが当たっていないとき、つまり熱放散が起こっていないときの、「全ての光化学系IIが開いている時の蛍光収率」と「全ての光化学系IIが閉じているときの蛍光収率」の差です。つまりこの差の大きさは光化学反応の有無によって蛍光に分配されるエネルギーがどれだけ変わるかを示すわけです。分子(Fm'-Fo')は、actinic lightが当たっているとき、つまり熱放散が起こっているときに、光化学反応の有無によって蛍光に分配されるエネルギーがどれだけ変わるかを示します。熱放散が起きると、そちらに流れるエネルギーが大きい分、光化学系でのエネルギー消費量変化が小さくなります。1からこの分数を引いていることで、熱放散が大きくなるほどqNも大きくなるというわけです。
実際の測定では、両パラメータともFo'の値を求めなくてはいけません。そのためには一度actinic lightを消す必要があり、連続測定時にはやっかいです。そのため、というわけでもないでしょうが、non-photochemical quenching の指標として、以下のNPQとかいうパラメータも使われています。
NPQ = (Fm - Fm')/Fm'
Fm'がFmより小さくなるのは熱放散が起こるからなので、この値によって熱放散の大きさを知ることができます。この値は1よりも高くなることもあります。
さて、qNにしろNPQにしろ、non-photochemical quenchingが大きくなると大きくなるパラメータであることには間違いはありません。しかし、それらの値が実際に何を意味するのか、になると今一ピンとこないのが実際です。私たちのグループでは、non-photochemical quenching で実際に消費されたエネルギー量を定量的に示す指標を使っています。それは、1-Fv'/Fm'、あるいはFv/Fm-Fv'/Fm'です。提案したのはDemmig-Adams et al. (1996) です。
以上のパラメータについての正しい説明はこちら。
さあ、本題です。
光阻害とは、可視光の照射により引き起こされる光合成速度の低下をいいます(Powles 1984)。光阻害の部位は光化学系IIであることが知られています(条件によっては光化学系Iであることもあります)。傷害を受けた光化学系IIの数が増えてくると、量子収率(吸収した光量子あたりの二酸化炭素固定速度)が低下します。Fv/Fmは量子収率(例えばDemmig and Bjorkman 1987)や、阻害されていない光化学系IIの割合(例えばOquist et al. 1992)と高い相関があることが本当に多くの仕事によって示されています。これらのことから、Fv/Fmは光阻害の程度の指標として一般的に利用されます。
Fv/Fmは、光阻害を受けていない葉で0.8-0.83くらいの値をとります。この値は多少の例外を除き、種間共通です(Demmig and Bjorkman 1987)。この値より低ければ、光阻害を受けている、と判断することになります。
長所
この方法の最大の利点は測定に時間がかからないことです。プローブ(測定光を出し、蛍光を感知するための光ファイバ)を向けて5秒もすれば測ることができます。これに対し、量子収率の測定では、酸素電極を使って、異なる光強度での酸素発生速度を数点測定する必要があります。どんなにうまくいっても測り始めてから10分は必要です。阻害されていない光化学系IIの定量は、flashを当てて酸素発生をみるのですが(そのうちどこかで解説したいと思います)、温度の影響など測定誤差が出やすく、面倒です。また、非破壊的に測定できることも魅力です。
注意点
光阻害を起こすためには光照射を行わなくてはいけません。しかし、光照射直後にFv/Fmを測定するとquenchingが起こるため、値が低く出ます。そのため、少なくとも15分以上は暗黒下においておいてから測定しないといけません(私たちの研究室では30-40分は暗黒下においています)。
電子伝達速度は英語ではelectron transport rate。というわけで、略してETR。これがETRの正体です。
クロロフィル蛍光から電子伝達速度が推定できることを示したのはGenty et al. (1989) です。私はこの仕事をちゃんと理解しているわけではないんですが、彼らの論理にしたがって説明しましょう。
上で定義したphotochemical quenching の係数qPは、「生きている光化学系IIのうち、酸化されている(QAに電子が渡されていない)光化学系IIの割合」と見なすことができます。酸化されている系II+還元されている系II=全ての系IIです。酸化されている系IIのみが電子伝達に有効であると考えます。逆に言うと、還元されている系IIにさらに電子が当たってもそれは電子伝達につかわれず、無駄になってしまう、ということです。qPは系IIにあたった光量子のうち無駄にならないものの割合ととらえることができます。
続いて、新しいパラメータを定義します。
Fv'/Fm' = (Fm' - Fo')/Fm'
です。このパラメータは、酸化されている系IIの量子収率(吸収光量あたりの電子伝達)に比例します。酸化されている系IIが光を吸収したとしても、non-photochemical quenching のために一部の光エネルギーは無駄になります。無駄にならず、電子伝達に利用された光量子の割合(に比例する値)ということになります。
この結果、系IIにあたった光量子のうちはたらける系IIにあたった光量子の割合(qP)と、そのうち電子伝達伝達に利用された光量子(Fv'/Fm')の積が、系IIが吸収した光量子あたりの電子伝達量ということになります。この系IIが吸収した光量子あたりの電子伝達量はFIIと略されることがあります。PAM2000ではYieldと呼ばれています。FIIは以下の式になります。
FII = Fv'/Fm'×qP = (Fm' - Fo')/Fm'×(Fm' - F)/(Fm' - Fo') = (Fm' - F)/Fm'
この(Fm' - F)/Fm'では、Fo'がなくなっていますので、光を照射した状態の測定のみで推定できるのが大きな利点です。
このFIIは、系IIが吸収した光当たりの電子伝達量ですので、実際の電子伝達速度を推定するためには、葉にどれだけ強い光が当たっているか、そのうちどれだけの光が系IIに吸収されているのかを知る必要があります。しかし、一枚の葉ならば、当てた光当たりどれだけが系IIに吸収されているのかは、一定値をとることが期待できます。したがって、FII×当てた光強度の値が葉面積あたりの電子伝達速度と比例することが期待でき、実際に、低O2濃度下での光合成速度と高い相関を持つことが示されています(Genty et al. 1989)。なぜ低O2濃度条件なのかは後で説明します。
FIIから電子伝達速度の絶対値を推定する式も示されています。光化学系IIのクロロフィルと光化学系Iのクロロフィルが吸収する光は1:1であると仮定すると、葉が吸収した光の半分が系IIが吸収する光ということになります。さらに、すでに述べたように、葉にあたった光の80-90%が光合成系に吸収されます。吸収率を仮に83%とすると、葉面積あたりの電子伝達速度ETRは以下の式から推定できるとされています。
ETR = FII ×0.5×0.83×incident PFD
incident PFDというのは、葉に照射した光の光量子密度です。ETRの単位はmol e- m-2 s-1となります(最大でも数100 μmol m-2 s-1だと思いますが)。この式は一般的に利用されています。しかし、私が考えまするに、この式には問題があります。一つは、0.5という値の妥当性です。光化学系IIのクロロフィルと光化学系Iのクロロフィルが吸収する光が1:1という仮定がどこまで通用するのかはわかっていません。クロロフィルbがない突然変異体などではこの値が明らかに1:1から外れており、FIIと光合成速度の関係は直線ですが、傾きが野生型と大きく異なります(Genty et al. 1989)。もう一つは、葉によって吸収率は違う、ということです。吸収率は積分球などを使えば測定可能ですが、光化学系のクロロフィルの分配の測定は厳密には難しいと思います。
長所
非破壊的に、短時間で測定できます。さらに、上で述べたようにFo'の測定の必要がないので、照射光を消したりする必要がありません。
注意点
電子伝達速度と光合成速度は必ずしも比例しないことに注意する必要があります。なぜかというと、葉緑体のCO2濃度に依存して、光合成と光呼吸の割合が変わるからです。例えば、弱光下では光合成速度が低いため、強光下に比べ葉緑体CO2濃度は高いです。葉緑体CO2濃度が高いと、光呼吸で消費されるエネルギーの割合が低くなるため、相対的に光合成速度が高くなります。別の葉の値を比べるときも、葉緑体のCO2濃度によって光合成/電子伝達比は異なることを念頭におかなくてはいけません。逆に、光合成速度/電子伝達速度の比を利用して葉緑体のCO2濃度を推定する方法が開発されています(Harley et al. 1992)。なお、Gentyらが低O2条件を利用したのは、光呼吸を抑えるためです。
・葉の全ての情報を網羅しているとは限らない。
蛍光測定は、測定光に対して葉が発する蛍光を測定しています。葉の表側にプローブを向けた場合、当然、入ってくる情報は葉の表側のクロロフィルから発せられるものが主になります。あるストレスにおいた葉の蛍光を、葉の表側から測ったときと裏側から測ったときでは違う値が出る、というのはよく聞く話です(論文を目にしたことはありませんが)。
・flashの強度
Fm やFm' を測定するときには、flashで全てのQAが還元されていることが前提です。Fmの測定時、つまり、暗所にしばらくおいた葉は比較的弱い光強度でQAを還元することができます。しかし、光合成をガンガンやっている葉では、photochemical quenching によるQAの酸化速度が速く、中途半端な光ではQAを全て還元することはできません。flashの強度を変えるなどしてQAを充分還元しているかをチェックする必要があります。
・蛍光の強度が変わる
ストレスを受けた光化学系IIでは、Foが上がることが知られています。これは、光化学反応に流れるエネルギーが少ないためです。このため、Foのモニタをする研究もあります。しかし、一部の植物では、葉緑体は当たる光強度に依存して動くことが知られています。葉緑体は円盤のような扁平な形をしています。強い光が当たっているときには、葉の内部へ光を通すように、葉緑体は光に対して平行になります。一方、弱い光が当たっているときには、葉緑体は光に対して垂直になり、光をより効率的に吸収できるようにします(Terashima and Hikosaka 1995)。こういう変化が蛍光強度にどのような影響を及ぼすかはわかりませんが、少なくとも、葉全体の光の透過率などは葉緑体運動に応じて変化することがわかっています(Terashima and Hikosaka 1995)。蛍光強度の絶対値(F、Fm、Foなど)を測定するときには注意が必要です。なお、Fv/FmやqPなどのパラメータは相対値なので、(たぶん)影響を受けないと思われます。
ちなみに、光化学系IIが傷んでもFoが上がらないことが多々あります。この原因はわかっていませんが、壊れた光化学系IIが何らかの方法でエネルギーを消費しているからではないかと考えられています。
・植物によっては光化学系Iのクロロフィル蛍光が無視できない。
一番上のほうに書きましたように光化学系Iからのクロロフィル蛍光は無視できる程度なのですが、光化学系Iの量が相対的に多い植物では、その量の多さのために蛍光が大きく、無視できないことがあるようです。例えば一部のC4植物やクロロフィルbがないミュータントは相対的に光化学系Iが多いものがあります。PAMシリーズの機種でこのような植物のクロロフィル蛍光を測定すると、Fv/Fmの値が低めになるようです。