光合成の生理生態学講座
目次
成熟した葉の光順化 (200607 14)
光合成系は同種・同個体の葉でも生育条件によって大きく性質が異なります。もっともよく知られているのが光条件に対する応答です。生育光条件によって光合成の性質が異なることは、すでに1932年にはBoysen Jensenによって示されています(もっと古い報告があるかと思いますが、知りません)。また、陽葉・陰葉という言葉があるように、よく知られた変化でもあります。ここでは、まず陽葉と陰葉の一般的な違いについてふれ、次にその生態学的意義について考察します。
光順化は、他の環境と比較してたいへん論文が多い分野でもあります。ここでは手元にある限りの論文を挙げる努力を少ししてみました。が、ここに挙げたものでもまだほんの一部だと考えたほうがいいでしょう。
陽葉と陰葉の違いは様々な性質について見られ、しかもかなりの性質が多くの高等植物に共通です。どういった性質がどう異なるかをずらずら文章にしても不毛なので、箇条書きにしてしまいます。
陰葉に比べ、陽葉のほうが・・・
形態について
葉の厚さ:厚い
葉面積あたりの重さ:重い
柵状組織の層の数:多い
葉の体積に占める葉内細胞間隙の割合:低い
(レビュー, Bjorkman 1981. 原著論文、Chabot & Chabot 1977, Patterson et al. 1978, Chabot et al. 1979, Jurik et al. 1979, Chazdon & Kaufmann 1993, Oguchi et al. 2003)
生理学的特性について(初期勾配以外は葉面積あたり)
葉面積あたりの乾燥重量:重い
最大光合成速度:高い
窒素含量:高い
気孔コンダクタンス:高い
(Boysen Jensen 1932, Bjorkman & Holmgren 1963, Loach 1967, Patterson et al. 1978, Osmond 1983, Walters & Field 1987, Chazdon & Field 1987, Sims & Pearcy 1989, 1991, Chazdon RL 1992, Ellsworth & Reich 1992, Hikosaka & Terashima 1996, Makino et al. 1997, Hikosaka et al. 1998a, Oguchi et al. 2003)
呼吸速度:高い
(Boysen Jensen 1932, Loach 1967, Sims & Pearcy 1991, Fredeen & Field 1991, Noguchi & Terashima 1997)
光−光合成曲線の初期勾配:あまり変わらない?
(Bjorkman & Holmgren 1963)
光阻害耐性:高い(Seemann et al. 1987, Aro et al. 1993, Oquist et al. 1992, Kato et al. 2002b)
(レビュー, Bjorkman 1981)
光合成系タンパク質(ただ含量と書いてあるものは、葉面積あたり)
RuBPCase含量:高い
chl含量:種によってまちまち
RuBPCase/chl比:高い
chl a/b 比:高い
PSII/chl比:高い
PSI/chl比:変わらない
LHCII/chl比:低い
cyt f/chl比:高い
CF/chl比:高い
その他カルビンサイクル酵素/chl比:高い
(レビュー, Boardman 1977, Anderson 1986, Evans 1989a, Evans & Seemann 1989, Terashima & Hikosaka 1995. 原著論文, Egle 1960, Wild et al. 1973, Osmond 1983, Leong & Anderson 1984a, b, Seemann et al. 1987, Evans 1987, Terashima & Evans 1988, De la Torre & Burkey 1990a, b, Hikosaka & Terashima 1996, Makino et al. 1997, Hikosaka et al. 1988b. なお、Australian Journal of Plant Physiology誌は1988年に光合成の光順化の特集号を組んでいます。この特集号に載っている論文は省略します。)
葉緑体の構造
グラナスタッキングの数:少ない
チラコイド膜の体積/ストロマの体積:低い
(文献はよく知りません。とりあえずTerashima & Evans 1988を挙げておきますが、これより古い仕事がたくさんあるはず)
(略称:RuBPCase-リブロース二リン酸カルボキシラーゼ、chl-クロロフィル、PSII-光化学系II、PSI-光化学系I、LHCII-光化学系IIの光集光クロロフィル-タンパク質複合体、cyt f-チトクロムf、CF-葉緑体ATPase)
(ここに挙げた文献は、基本的には、ある条件のもとで育てた個体・個葉の研究、もしくは野外のある光条件で育っている個体・個葉の研究です。群落の中の光条件の不均一性に着目した研究は除外してあります)
といったところでしょうか。こういった違いにどのような意義があるかについては、下の「成熟した葉の光順化」もご覧下さい。
生理学的性質の可塑性にも種間差はあります。いわゆる陰生植物と総称される、強光に適応できない種やエコタイプでは、強光に移すとかえって光合成能力が下がったりします(Bjorkman & Holmgren 1963)。
ヒマワリとかアサガオとか、広葉の植物を考えて下さい。光は上から降ってきます。先にも述べたとおり、普通葉はあたった光の80-90%を吸収します。これらの光は葉緑体に吸収されるわけですが、全ての葉緑体が同じように光を吸収するわけではありません。葉の表側にある葉緑体がまず強い光を吸収します。これらの葉緑体が吸収できずにもれてきた光を裏側にある葉緑体が吸収します。したがって、表側の葉緑体ほど明るい環境で生きていることになります(Terashima & Saeki 1983)。
葉緑体の性質も均一ではなく、表側の葉緑体ほど、グラナスタッキングの数が少ない、RuBPCaseが多い、chl a/b比が高いなど、陰葉陽葉の違いに相当する違いが見られます(Terashima & Inoue 1984, 1985)。これについては「光合成システムとしての葉」の「葉緑体の順化」をご覧下さい。また、葉緑体の性質の違いにより、葉の表から光を照射したときと裏から光を照射したときでは光−光合成曲線の形が変わります(Terashima 1986)。詳しくは「光−光合成曲線の凸度」で説明しています。
このあたりの総説は、Terashima(1989), Terashima & Hikosaka(1995)などをご覧下さい。
強光ほど高い窒素含量をもつほうが有利である、ということについては、「光合成の適応性:窒素利用」の「最適な窒素含量」で説明する予定です。
さて、葉っぱがどれだけ窒素をもっているか、ということと、葉にある窒素をどのように利用するか、ということは論理的に言って別の問題です。葉の窒素の50%以上が光合成系のタンパク質です。上に書いたように、光合成系のタンパク質の量は厳密に制御されており、条件によって組成比が異なります。今度は光合成タンパク質の比の変化にどういった意味があるかを考えてみましょう。
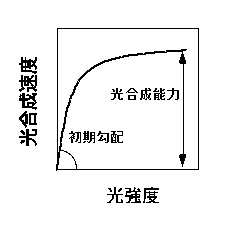
前に説明したように、光−光合成曲線は最大光合成速度と初期勾配によって特徴づけることができます(下図)。

光−光合成曲線の模式図。彦坂(1997)のグラフの線を縮小して、字を縮小しませんでした。
初期勾配は葉のクロロフィル含量に対し飽和型に増加することも説明しました(Gabrielsen 1948)。このことから、弱光下の光合成速度を増すためにはクロロフィル含量を増すことが必要であることがわかります。クロロフィル1分子はたった4つの窒素を持っているだけですが、全てのクロロフィルはタンパク質と結合しており、この複合体に含まれる窒素は葉の窒素の10-25%を占めます(Evans & Seemann 1989)。特に、葉をすりつぶした液を電気泳動してみるとわかりますが、光集光性クロロフィル-タンパク質複合体(LHC)のアポタンパク質は葉の中でRuBPCaseの次に多いタンパク質であると思われます。一方、最大光合成速度を増やすためには、電子伝達系のタンパク質,ATP合成酵素,カルビンサイクルの酵素を増やすことが必要です。葉の窒素は限られているので,初期勾配に関わる窒素と光合成能力に関わる窒素との間でTrade-offが成り立つことになります。このTrade-offを簡単なモデルで初めて示したのはEvans (1989b, c)です。私は彼の理論をさらにすすめ,光合成系タンパク質の資源分配モデルを作りました(Hikosaka & Terashima 1995)。図は私のモデルによるシミュレーションの結果の一部です。
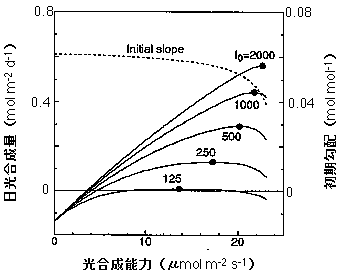
葉の窒素含量を一定に保ったときの、飽和光下の最大光合成速度(光合成能力)と一日の光合成量の関係(実線)と、光合成能力と初期勾配の関係。一日の光合成量は異なる5つの光条件を仮定している。一日の光強度変化はサイン二乗カーブを仮定しており、I0は昼に太陽が南中したときの光強度(μmol m-2 s-1)。つまり、I0が高いほど強光条件。実践上の黒丸は、各光条件で日光合成量が最大になる点を示す。Hikosaka & Terashima (1995) をちょっと改変。この論文を書いた頃はまだPC98を使っていたので、この図はスキャナで取り込みました。自分のグラフなのに。コピーを繰り返したので。汚い・・・。
ここでは葉の窒素含量を一定に仮定しており、カルビンサイクルの酵素などを増やすとクロロフィルタンパク質複合体の量が自動的に減るようになっています。最大光合成速度を増やすと、初期勾配が下がります(点線)。一日の光合成量は、最大光合成速度を上げると上昇しますが、あまり最大光合成速度が上がりすぎると、初期勾配が下がりすぎるため、かえって日光合成量は減少します。一日の光合成量を最大にする、最適な最大光合成速度/初期勾配がある、ということになります。また、この最適な最大光合成速度/初期勾配は光条件によって異なります。弱光ほど最大光合成速度が低く、初期勾配が高い葉が有利になります。つまり、強光ではカルビンサイクルタ酵素などを多くしたほうが、弱光ではクロロフィルを増やしたほうが有利であるというわけです。模式的には以下の図のような感じで想像して下さい。
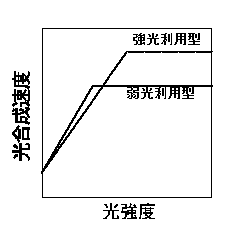
弱光利用型と強光利用型の光−光合成曲線の模式図。弱光利用型は初期勾配が高くて光合成能力が低い。わかりやすくするため、曲線を直線で表す、差を大きく見せるためのデフォルメなどを行っています。彦坂(1997)のグラフの線を縮小して、字を縮小しませんでした。
ただし、この図では窒素含量が等しいことを仮定しているうえ、初期勾配の違いが誇張されています(ちゃんとした予測については、Hikosaka & Terashima 1995を見て下さい)。実際の葉では窒素含量そのものが強光で高くなりますので、chl/N比が低くても、chl含量や初期勾配が強光で下がるとは限らないことに注意して下さい。モデルにより予測された最適なタンパク質組成は上で述べたような実際の植物で見られる傾向と一致します(Hikosaka & Terashima 1995, Hikosaka 1996)。
さらに私は陽生植物シロザと陰生植物クワズイモを異なる光条件で生育させ、モデルの予測と実際のタンパク質分配を定量的に比較しました(Hikosaka & Terashima 1996)。その結果,両種とも広範囲の光条件で最適に近い分配を実現していることが示されました。ただし、実験における最も暗い条件であった相対光強度5%区ではシロザのタンパク質分配は大きく予測と異なり、陽生植物が非常に暗い条件には順化しきれないことを示唆しました。
上の表にも出ていますが、光化学系の組成も光環境とともに変化します。よく知られているのは、chl aとchl bの比(以下chl a/b比)が変化することでしょう。この変化は古くから知られています。私が知っている中ではEgle (1960) が一番古い報告らしいのですが、読んではいません(ドイツ語らしいので)。
光化学系にはクロロフィルと結合するタンパク質(サブユニット)がいくつかあります(光化学系についてはこちらもご覧下さい)。(おそらく)chlと結合するすべてのサブユニットはchl aは必ず持っています。つまり、chl aしかもっていないサブユニットと、chl aとbの両方を持っているサブユニットがあるわけです。chl aしか持っていないサブユニットは、反応中心複合体を構成するサブユニットです。両方持つサブユニットは反応中心複合体とは弱く結合しており、「光捕集chl-タンパク質複合体(light harvesting chl-prototein complex, LHC)」と呼ばれます。なお、「反応中心」そのものはchl aであると言われています(PSIIではP680、PSIではP700)が、各反応中心複合体は一つしか反応中心を持ちません。反応中心複合体は数十個のchl aを持ちますが、反応中心以外はいずれも光捕集の役割を持っています。LHCにくっついているchlではないからといって、反応中心としてはたらいているわけではかならずしもありません。
chl a/b比は弱光条件ほど低くなります。chl a/b比が下がるということはつまるところ反応中心複合体に対し、LHCの数が増えていることを意味します。このことから、「LHCを増やすことにより集光力を高める」という発想をする人がいますが、かならずしもそうではありません。
まず、chl bはchl a に比べて吸収率が高いわけではありません。Evans & Anderson (1987)は光化学系をmildな条件で電気泳動して、各サブユニットがクロロフィルと結合したまま分離しました。400-720nmの間の波長での吸光度の平均は各サブユニットのa/b比には全く依存しませんでした。
ただし、吸収の点でchl bを持つことに全く意味がないわけでもありません。chl aとbは吸収スペクトルが若干異なります。林床などで上層の葉を透過してきた光ではchl aが吸収しきれなかった波長の光の割合が高くなり、chl b を持つことによりその光を吸収できるチャンスが高くなります。このメリットがどれだけ高いかを検討したことは私はありません。あまり大きくないと考えていますが・・・。
では、chl a/b比の減少にはどのような意味があるのでしょうか? ここには、「窒素のコスト」が大きな意味を持ちます。chl1分子を持つために、どれだけの窒素が必要でしょうか? chlそのものは、 aもbも1分子あたり4分子の窒素を持つという点は変わりません。しかし、chlがくっついているサブユニットは違います。反応中心は電子伝達という機能も持っているため、たいへん窒素コストがかかります。したがって、反応中心複合体の窒素コストはたいへん大きなものです。しかし、LHCは集光しか機能がないぶんコストも割安です。したがって、同じchl1分子を持つためなら、LHCを作ったほうが有利なのです(Evans 1987)。では、なぜ強光ではわざわざコストのかかる反応中心複合体を増やすのでしょうか? それは簡単、反応中心が増えないと、電子伝達活性が高くならず、光合成能力を上げることができないからです。つまり、ここではたらいているトレードオフは、光合成能力と集光のための窒素コストの間にはたらいていると言えます(Hikosaka & Terashima 1995)。光化学系IIの反応中心とLHCのバランスが変化することにより、chl1分子あたりの窒素コストは1割程度変わるようです(Evans 1987)。
ただし、この話はあくまで光化学系IIに限られるらしい、ということを注意してもらわなくてはいけません。つまり、光化学系IIの反応中心とLHCIIの間の話に限られるわけです。光化学系IにもLHCはあるのですが(LHCI)、反応中心とLHCIの比は、少なくとも光化学系IIほどには変化しないようです。Anderson (1986) のレビューでは、この比も光強度とともに変化する、ということになっていますが、多くの研究での測定では、光化学系Iの反応中心(P700)と葉のchl量の比は光条件に依存しません(Evans 1987, Terashima & Evans 1988, Chow & Anderson 1990a, b, Hikosaka 1996, Hikosaka & Terashima 1996)。光化学系Iのchl/葉のchlが一定であると仮定するならば、反応中心/LHCは変わらないことになります。私の研究ではかなり生育光を弱くしたときのみP700/chlが下がる、という結果を得ていますので(Hikosaka & Terashima 1996)、全く変化しないわけではないかもしれませんが、おおざっぱには、変化しないと考えていいのではないか、というのが現時点での印象です。なぜ光化学系IとIIでこのように応答が異なるのかはわかっていません。が、面白い示唆があります。ラン藻では光化学系IIはLHCを持ちますが、光化学系Iにはありません。したがって、光化学系IがLHCを持ったのは進化的には比較的最近、ということになります。進化的な制約から、光化学系Iには可塑性が低いのではないか、という説を出すことはできます。
どこかで述べたとおり、葉はあたった光の80-90%を吸収することができます。吸収スペクトルには以下の特徴があります。1)紫外域はよく吸収する(chlの他に、核酸やタンパク質も吸収する)。2)可視域では、赤と青をよく吸収し、緑は比較的吸収しない。3)赤外域はほとんど吸収しない。
ただし、2番には注意が必要です。chlを有機溶媒に溶かして吸光度をみると、緑での吸光度は非常に低いです(赤の1/5以下)。しかし、葉っぱの緑の吸光率はそこまで低いわけではありません。葉っぱの中で光が散乱してしまうことで光が葉の中を進む距離が長くなり、結局吸収されてしまうのです。ちなみに、散乱は細胞壁と細胞間隙の間で光が屈折することで起こります。細胞の形も関係しており、柵状組織のような円筒形の細胞ではあまり散乱は起こらず、柔組織のような丸い細胞ではよく起こります。このため、柵状組織と柔組織ではchlあたりの吸光度が変わります(Terashima & Saeki 1983)。面白いことに、細胞間隙を液体で満たして屈折を起こらなくしてやると、緑の光がよく通るようになります。詳しくは朝倉書店の現代植物生理学・1・光合成(宮地重遠編)をご覧下さい。
緑はともかく、赤外線はほとんど吸収されません。このため、葉に被陰された世界というのは、可視光が遮られ、赤外線はばんばん通ってくる、ということになり、光の波長組成(質)が群落上部と下部では大きく異なります(Holmes & Smith 1977a, b)。
この光の質の変化が光合成系に影響を与えるのではないかと推測されてきました。二つの全く意味の異なる影響が考えられています。
一つは、光合成系の順化にファイトクロムが関わっているのではないか、という問題です。植物は、赤/赤外の比を感知できる色素を持っています。ファイトクロム(phytochrome)と呼ばれます。ファイトクロムについては詳しく述べませんが(よく知らないから。1998年のPlant, Cell & Environmentで特集号を組んでいます)、茎の伸長、葉の緑化、短日植物の開花など多くの形態形成に関わっていることが知られています。例えば、もやしに赤外線を一日に15分間だけあてる、という処理を行うととそのあとひょろひょろに伸びますが、赤外線をあてた後に赤い光を15分あてると、この効果は消えます。
もしファイトクロムが効いているのならば、ただ光を遮光しただけの条件と群落下部の光条件では光合成系に変化が起こるかもしれません。また、ここまで全くふれていませんでしたが、光順化において光環境の変化を感知しているメカニズムは何か、という問題があります。Casal & Smith (1989) は、ファイトクロムは光の強さも感知できるかもしれない、として、ファイトクロムが質だけでなく量の変化にも意味を持つことを示唆しました(この説がその後どうなったかは知りませんが)。
もう一つの影響は、二つの光化学系の光吸収のバランスの問題です。光化学系IとIIは微妙に吸収スペクトルが異なります。なぜかはよく知りませんが、光化学系Iのほうがわずかに赤外域を吸収することができます。このため、赤外線をあてると、光化学系Iを励起できるけれど、光化学系IIは励起できない、ということがおきます。これでは二つの光化学系のバランスが悪いので、赤外線が相対的に強くなる環境では、光化学系Iを減らしてIIを増やし、バランスをとっているはずだ、という説がMelisらのグループによって提唱されました。実際、赤外線が相対的に多い環境ではPSII/PSI比が高くなるようです(Melis & Harvey 1981)。彼らの考え方が正しければ、群落の下部ほどPSII/PSI比が高くなります。これは、ここまでしてきた説明とは矛盾することに注意して下さい(上の表参照)。ほとんどの光順化の研究は光の波長組成は変えません。このような状況では、弱光ではPSII/chlが下がり、PSI/chlは変わらないわけですから、PSII/PSIは弱光で下がることになります。この点はMelisのグループとAndersonのグループで論争が起こったらしいです。
では、実際はどうなのでしょうか?
まず、ファイトクロムの影響ですが、「ない」か、もしくは「マイナー」です。近年はファイトクロムが欠損した変異体が得られています。欠損変異体でも光順化は起こります(Smith et al. 1993)。ですから、ファイトクロムが中心的な役割を果たしていることはまずないといっていいでしょう。ファイトクロム分子には数種類あることが知られています。メジャーなのはファイトクロムAとBですが、それぞれの遺伝子をつぶしただけの変異体は野生株とほとんど応答に違いがありません。AとBの両方をつぶした変異体では順化そのものは起こるものの、野生株とは光合成能力などにおいて多少定量的には異なるようです。このことから、Smithらは「ファイトクロムには光順化に対するなんらかの役割はある」とは考えているようです。ただ、突然変異体を用いる仕事の常として問題になるのは、変異体では光合成系以外にも変化が起こっているはずで(例えば形態など)、そういった別の形質の影響を通した間接的な影響と直接的な影響の区別がつくのか、という疑問です。私の印象は「ファイトクロムの影響はほとんどない」です。
次に、光化学系のエネルギーバランスの問題です。これはとにもかくにも実験的に得られているわけですから、波長組成が変化するとPSII/PSI比が変わる、という事実の否定はありえません。特に、Chow et al. (1990a) は異なる波長組成で植物を育て、PSII/PSI比が変わるかだけでなく、その意義まで調べています。彼らはPSIだけが吸収できる光を増やしたり、あるいはPSIIだけが吸収できる光を増やし(PSIはchl bの含量がたいへん少ないので、chl bの吸収が高く、chl aの吸収が弱い光をあてるとやはりバランスが変わる)て植物を育て、PSII/PSIが変わること、量子収率はその植物が育った光条件で高いことを示しました。バランスが悪いと無駄になる光が多いため、量子収率が落ちるのです。
問題は、この影響が野外でメジャーなのか?ということです。つまり、林床条件ではPSII/PSI比は高いのでしょうか?低いのでしょうか? 答は「低い」です(Chow et al. 1990b)。Chow et al. 1990bの論文の著者は、Anderson、Melisですので、この論文が論争に決着をつけたものと私は考えています。これはどう解釈すべきなのかは難しいのかもしれませんが、私の考えるところ、いくつか解釈を示すことができます。一つは、質の違いによるバランスの違いはそれほど問題にならないのではないか、ということです。バランスが問題になるのは光合成速度が光に律速される間だけで、ちょっとでも強い光があたれば、林床に生えている植物の光合成能力は低いですからすぐに光飽和してしまいます。まあ林床ですから暗いわけで、光律速になっている時間も長いとは思いますが、実験条件のように一日いっぱい光律速になっているわけでもないでしょう(Chow et al. 1990cなどでは、生育光条件は45μmol m-2 s-1)。もう一つは、赤外線だけが相対的に増えるわけではないということです。上にちょっと書いたように、光化学系Iはほとんどchl bをもっていませんが、LHCIIには多くのchl bがあります。上層の葉っぱはchl bが少ないはずですから、透過してきた光にはchl aは吸収できないけどbが吸収できる光の割合が無視できなくなる可能性があります。この結果、林床ではバランスはそれほど変わらないんじゃないの、という意見です(これは現大阪大の寺島教授からずいぶん昔に聞いた説です)。最後に、光の量への応答に比べ、質への応答はもともと小さいのだ、ということが考えられます。野外の条件に近い波長組成と、そこから赤外線だけ増やした波長組成で育てても、PSII/PSI比の違いは高々20%です(Chow et al. 1990c. なお、野外ではありえないような波長組成にすると、もっと変わり得ます)。が、陽光100%と10%ではこの比は2倍近くまで変化します(例えばHikosaka 1996, Hikosaka & Terashima 1996)。もともと変わりうるレンジが違うのでしょう。
なお、光の質に応答したPSII/PSI比の変化がファイトクロムによって調節されているか否かについても結論が出ています。答は「否」です(Chow et al. 1990c)。この実験では、日中ずっと赤外線をあてた条件と、夕方だけ15分赤外線をあてた条件でPSII/PSI比を比べました。ファイトクロム調節なら両者には差がないはずですが、バランスが変化したのは日中ずっとあてたほうだけでした。このことから、光合成系はバランスの変化そのものを感知しているのではないかと考えられています。
さて、ここまではPSII/PSI比についてしか書きませんでしたが、他の性質と光の質の関係はどうなんだ、ということになります。しかし私の見解は(そしてたぶん世の中の見解も)、「あまり関係ないんじゃない」、というものです。たしかに赤外線を増やしてやることで他の性質に若干変化があったりするようですが(例えば光合成/chlがほんのちょっと増えるなど−Chow et al. 1990c)、しかし、これは「赤外線を増やした分だけ強光条件になるため」と解釈してもあまり矛盾はないように思います。
ここまでの話は、基本的には「その光条件で発生し、成熟した葉」の話です。いったんある光条件で成熟した葉を別の光環境に移した場合は少し話が変わります。というのは、一度展開し、成熟した葉の形態は、光条件を変えてもそれほど大きくは変わらないということが知られています(Jurik et al. 1979)。一方、光合成能力や光合成系タンパク質組成などの生理的性質は同じ光条件で出た葉を異なる光条件に移したときにも変化します(Davis et al. 1986, Besford 1986, Ferrar & Osmond 1986, Chow & Anderson 1987a,b, Olesinski et al. 1989, De la Torre & Burkey 1990a, b, Hidema et al. 1991, Mae et al. 1993, Turnbull et al. 1993, Hikosaka 1996)。可塑性の高い種ですと、強光条件で出た葉と弱光から強光に移した葉とでほとんど違いが見られないという報告もあります(De la Tore & Burkey 1990a, b)。陰葉を強光に移植した場合、葉に何が起こるか、ということは、小口理一くんが非常に面白い研究をしてくれました。
彼が最初に扱ったのはシロザです(Oguchi et al. 2003)。弱光条件で育てたシロザの葉(以下LL葉)は光合成能力が10(μmol m-2 s-1)でしたが、これを強光に移すと(以下LH葉)、約4日で17まで上がりました。ちなみに最初から強光で育てた葉(HH葉)の光合成能力は27でした。光合成能力はLL・LH・HH葉を通してRuBPCase含量と相関があり、LH葉の光合成能力増加の生理学的原因はRuBPCase量の増加であることがわかりました。面白かったのは解剖学的観察の結果です。葉の厚さはLL葉とLH葉で1割程度しか変化がありませんでしたが、葉緑体の体積がLH葉で30%ほど増加していました。葉緑体は葉肉細胞の中にありますが、二酸化炭素を効率よく受け取るために細胞表面付近にのみ存在します。HH葉やLH葉では細胞表面はほとんど葉緑体によって埋め尽くされていた(細胞表面の95%に葉緑体が存在していた)のですが、LL葉では葉緑体が存在しない「隙間」が30%ほどありました。つまり、強光へ移すことにより「隙間」を埋めるように葉緑体が増えたことになります(下図)。
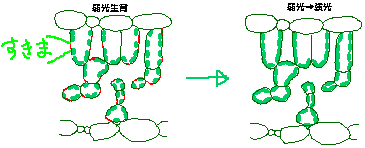
シロザ成熟葉の強光順化の模式図。原図は小口くんによります。
この結果は、以下のように解釈されます。
光合成能力を増やすためにはRuBPCaseなど光合成系タンパク質を増やさなくてはいけない。
光合成系タンパク質を増やすためには葉緑体の体積を増やさなくてはいけない
葉緑体はCO2を効率良く受け取るために細胞表面付近に存在しなければならない
葉緑体の体積を(光合成に貢献できるように)増やすためには、葉面積あたりの葉肉細胞表面積を増やさなければならない・・・葉の内部形態が光合成能力を制限している
→高い光合成能力を持つためには、葉を厚くし、細胞表面積を増やす必要がある
しかし、成熟した陰葉は葉の形態を大きく変化させることはできません。したがって、陰葉が光合成能力を高めるためにはあらかじめ葉を厚くしておき、細胞表面積を多く作っておく必要があるのです。言い換えると、シロザの陰葉はいつか光環境が改善したときのために葉を厚くして「隙間」を開けている、と考えられるのです。
さて、陰葉の光順化能力には種間差があることがわかっています(Turnbull et al. 1993, Yamashita et al. 2000)。例えば、Yamashita et al. (2000) は小笠原に生育する5種の木本の陰葉の光順化可塑性を調べ、ある種では全く変化がなく、侵入種アカギは大きな可塑性をもっていたことを示しています。このような種間差に葉の形態的制限がかかわっているのでは、ということで彼は木本3種を調べて見ることにしました(Oguchi et al. 2005)。ダケカンバの応答はシロザと同様で、陰葉はある程度「隙間」をもち、強光に移すと葉緑体体積が「隙間」を埋めるように増加し、光合成能力も増加しました。対照的に、ブナの陰葉は「隙間」があまりなく、強光に移しても葉緑体体積が増えることもなく、光合成能力も増加しませんでした。これらの結果は、「隙間」の有無が強光順化における光合成能力の増加を制限していることを示しています。意表をついたのはウリハダカエデでした。ウリハダカエデでは、葉の厚さが18%増え、葉肉細胞表面積も28%も増加しました(シロザの場合は、葉が厚くなったが細胞表面積は増えなかった)。この結果から、成熟後に葉の形態を変えることができる種がいることが明らかになりました。
この後、小口くんは実際の林で木を切り倒してギャップを作り、林床の木本実生が自然界の強光変化にどのように応答するかを調べました(Oguchi et al. 2006)。この結果からすると、シロザやダケカンバに見られるような応答は多くの種に広く見られる性質のようです。また、まだ3種の情報しかありませんが、カエデの仲間は葉の形態的可塑性をもてるようです。まだまだ調べることがある、と考えています。