最近の論文から *以下のリンクは別ウィンドウで開きます
鳥類のはばたき飛翔の進化に重要な骨形態である肩峰烏口突起の発生について
Takeda, Y., Kuramoto-Ahuja, T., Yonei-Tamura, S., Shibuya, H., Tamura, M., Uesaka, M., and Tamura, K. Ontogenic Development of the Acrocoracoid Process Responsible for the Evolution of Avian Flapping Flight. Zoological Science. 2026, 43(1). doi: 10.2108/zs250113
現生の鳥類が翼を上下に動かしてはばたくとき、翼を「振り上げる」動きは、肩帯の腹側にある烏口上筋(うこうじょうきん)によって生み出されます。「腹側」の烏口上筋の収縮が上腕骨を「背側」に持ち上げるという一見すると矛盾してみえる動きを実現するため、鳥類は三骨間孔(さんこつかんこう)と呼ばれる筒状の構造を進化させました。三骨間孔は滑車のような機能を持っており、烏口上筋の腱がこの孔を通って上腕骨に接続することで、烏口上筋の収縮は上腕骨を背側へと引っ張り上げる力に変わります。三骨間孔は肩帯を構成する3つの骨要素(肩甲骨、烏口骨、鎖骨)の突起によって形成されますが、なかでも烏口骨の背側端にある肩峰烏口突起(けんぽううこうとっき)は、三骨間孔の機能を実現するために不可欠な構造です。そのため、この突起は現生の鳥類がはばたき飛翔を行う鍵となる形態であると考えられています。本研究では鳥類胚の肩の筋骨格系について、肩峰烏口突起の発生に焦点を当てて、形態学的・組織学的解析を行いました。その結果、肩峰烏口突起は、まだ軟骨原基の段階にある烏口骨の背側端が側方に突出するかたちで形成されることが分かりました。烏口上筋の腱の側方への伸長も同じ時期に起こっていました。さらに組織学的解析によって、ちょうど肩峰烏口突起の形成が起こる時期に、上腕二頭筋、烏口腕筋、小三角筋を含む複数の四肢筋が肩峰烏口突起の軟骨原基に付着していることが示されました。今回の研究によって、発生学的観点から肩峰烏口突起の詳細な形成過程が初めて明らかになりました。このことは現生の鳥類がどのようにはばたき飛翔の能力を獲得したのか、その起源を発生メカニズムから理解するための端緒となると考えられます。

胚発生期のニワトリ胚の3次元形態解析により、肩峰烏口突起の伸長と同時期に、烏口腕筋(橙色)などの背側の筋や、前翼膜筋(緑色)、大三角筋(青色)などの腹側の筋が突起に付着していることが確認された(左図)。本研究によって、肩峰烏口突起は、肩帯や翼の軟骨原基が形成される時期に烏口骨骨端の軟骨原基が伸長することで形成されること、突起の伸長時には複数の筋が付着していることが明らかになった(右図)。
Figure 3, 5より改変。
真骨魚類特異的な鰭骨格の減少におけるshh関連遺伝子の役割
Tanaka, Y., Okayama, S., Urakawa, K., Kudoh, H., Ansai, S., Abe, G. and Tamura, K. (2024). Anterior-posterior constraint on Hedgehog signaling by hhip in teleost fin elaboration. Development, 151 (22): dev202526. doi: 10.1242/dev.202526
現生魚類の大部分を占める真骨魚類は祖先的な形態を残す軟骨魚類(サメ・エイ)や基盤的条鰭類(チョウザメ・ガーなど)と比較して様々な形質を変化させています。その変化の1つとして、真骨魚類は胸鰭の担鰭骨(radial)と呼ばれる骨格を減らし、水中での左右の方向転換やホバリングに適した構造を作り上げてきました。私たちはこの真骨魚類特異的な胸鰭担鰭骨の減少がどのような発生メカニズムを介して生じたのかを明らかにしたいと考え、真骨魚類であるゼブラフィッシュにおいて胸鰭骨格の増加を引き起こすhhip遺伝子変異体に着目しました。hhip変異体の胸鰭における発生過程や遺伝子発現観察の結果、胸鰭の担鰭骨増加は胸鰭原基の中間領域が特異的に大きくなることで生じていることが明らかになりました。hhipがshhシグナルの抑制因子として働いていることを踏まえると、この胸鰭原基の中間領域に対し作用するshhシグナルの強さが胸鰭の担鰭骨数を決めていると考えられます。同様の鰭骨格の減少は胸鰭だけでなく真骨魚類の腹鰭や尾鰭においても生じていますが、hhip変異体ではこれら腹鰭や尾鰭でも骨格数の領域特異的な増加が見られました。このことは真骨魚類とその祖先にあたる魚類の間でshhシグナルの抑制する何らかの変化が生じ、複数の鰭にて同時的に鰭骨格の減少を達成した可能性を示唆しています。
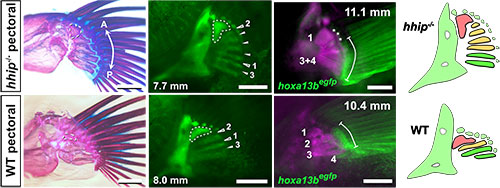
野生型とhhip変異体の胸鰭骨格を比較すると、担鰭骨の増加によって鰭全体が広がっていることがわかる(左図)。どの領域の担鰭骨が増加したのかを調べるために、発生過程での各骨格の形成順序(中央左図)や領域特異的な発現を示す遺伝子(中央右図)の観察を行った。その結果、野生型では第二担鰭骨(右図オレンジ)に相当する領域がhhip変異体では担鰭骨の増加を引き起こしていることが明らかになった。
Figure 1, 2, 6, 7より抜粋。
顎口類ゲノムの遺伝子スクリーニングによる魚類特異的遺伝子の同定とそれらの遺伝子の鰭発生における機能
Kudoh, H., Yonei-Tamura, S., Abe, G., Iwakiri, J., Uesaka, M., Makino, T. and Tamura, K. (2024). Genomic screening of fish-specific genes in gnathostomes and their functions in fin development. Development, Growth & Differentiation, 1–13. doi: 10.1111/dgd.12918
ある動物群がそのグループ固有の遺伝子をもち、それがそのグループ特有の形質にとって重要であるという例が多く報告されています。私たちは、顎口類のなかで魚類に特有の形質である鰭の発生において、魚類固有の遺伝子が果たす役割を明らかにし、鰭という形質の形成の根底にあるメカニズムの解明に繋げたいと考えました。そこでまず、顎口類のなかの16種の魚類と35種の四足動物の遺伝子レパートリーを網羅的に比較し、91個の魚類特異的遺伝子を同定しました。次にトランスクリプトーム解析により発生過程の胸鰭におけるそれら91個の遺伝子の発現動態を調べ、そのなかで発生中の胸鰭で発現する33個の遺伝子を選んで、そのうち約半数の遺伝子について機能解析を行いました。その結果、既知のfgf24遺伝子やand1/and2遺伝子を含む複数の遺伝子が鰭の発生に関わっていることが示されました。とくに新規に同定された魚類特異的遺伝子であるqkia遺伝子は、発生中の鰭を含む筋肉で発現し、体幹筋に加えて胸鰭の筋肉でも形態形成に寄与していました。これらの結果は、ある動物群に固有の遺伝子をゲノムワイドな遺伝子スクリーニングによって同定する今回の方法が、そのグループ特有の形質の形成メカニズムへのアプローチ法として有効であることを示しています。
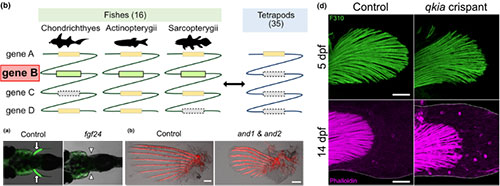
顎口類のうち鰭をもつ軟骨魚類、条鰭魚類、肉鰭魚類を魚類として、これらの動物に共通して存在し、四足動物には存在しない遺伝子を魚類特異的遺伝子として同定した(左図上)。発生中の鰭で発現する魚類特異的遺伝子のうち、fgf24遺伝子を機能阻害すると胸鰭が欠失し、and1/and2遺伝子を機能阻害すると鰭条形成が異常になる(左図下)。またqkia遺伝子の機能阻害は胸鰭の筋肉の形成や配向に異常を引き起こした。
Figure 1,4,5より改変。
棘鰭上目の新しいモデル動物としてのレインボーフィッシュII:遺伝子工学のためのマイクロインジェクション法
Miyamoto K., Abe G., Kawakami K., Tamura K. and Ansai S. The dwarf neon rainbowfish Melanotaenia praecox, a small spiny-rayed fish with potential as a new Acanthomorpha model fish: II. Establishment of a microinjection procedure for genetic engineering. Developmental Dynamics. 2024, 1-14. doi: 10.1002/dvdy.698
レインボーフィッシュはカラフルな淡水魚の仲間で、なかでも小型のレインボーフィッシュであるネオンドワーフレインボー(Melanotaenia praecox)は実験動物種に適したな生物学的特徴をもっています。私たちは、このレインボーフィッシュが、生態学や進化学、発生生物学など様々な分野で新しいモデル種となるのではないかと考えています。しかし、この種を用いて分子メカニズムや遺伝子メカニズムを研究するための準備はあまり整っていませんでした。そこで私たちは、このレインボーフィッシュを用いた遺伝子工学的手法の確立を試みました。まず、CRISPR/Casシステムを用いたノックアウト法によってチロシナーゼ遺伝子をノックアウトし、ほとんどの色素を欠いた胚の作出に成功しました。また、Tol2トランスポゾンを用いた遺伝子導入法により、ユビキタスプロモーターにつないだGFP遺伝子が高効率でゲノムに導入されるのを確認しました。これらの遺伝子工学的手法の確立により、このレインボーフィッシュで起こる幅広い生物学的現象について、遺伝子メカニズムを研究するための道が開かれました。今後、レインボーフィッシュが様々な実験生物学分野の新たなモデル種になるものと期待されます。
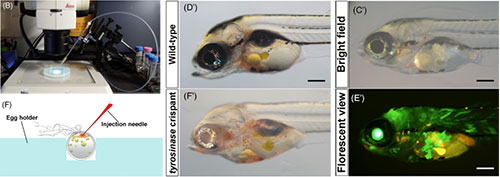
CRISPR/Casによるゲノム編集法とTol2を用いた遺伝子導入法に必要なマイクロインジェクションを行うための顕微鏡システム(左図上)とマイクロインジェクションの模式図(左図下)。CRISPR/Casシステムを用いたゲノム編集によりチロシナーゼ遺伝子をノックアウトすると、体幹の色素が失われる(中央図)。またユビキタスプロモーターで駆動されるGFP遺伝子を含むTol2コンストラクトを遺伝子導入することで、高効率でGFPの発現を誘導できた(右図)。
Figure 2-4より改変。
棘鰭上目の新しいモデル動物としてのレインボーフィッシュI:鰭条の個体発生と胚発生後の発生段階
Miyamoto, K., Abe, G. and Tamura, K. The dwarf neon rainbowfish Melanotaenia praecox, a small spiny-rayed fish with potential as a new Acanthomorpha model fish: I. Fin ray ontogeny and postembryonic. Developmental Dynamics. 2024, 1-17. doi: 10.1002/dvdy.699
魚の鰭は様々な色や形をしており、多くの機能を担っています。棘鰭上目の魚の鰭には、軟条と棘条という2種類の鰭条骨格がありますが、そのうち棘条はとくに様々な機能をもち、極端に変形した棘条をもつ種も知られています。しかし一般的な魚のモデル種であるゼブラフィッシュやメダカは棘条をもっていません。ティラピアなど棘条をもつ魚のモデル種も存在しますが、それらを普通の研究室の設備で飼育するのは難しいのが現状です。棘条をもつレインボーフィッシュ(Melanotaenia praecox)は小型の淡水魚であり、年間を通して産卵し世代時間も短いなど実験動物に適した特徴をもっています。本研究では、棘条発生のモデル種としてレインボーフィッシュを用いるために、鰭が形成される時期である胚発生後の個体発生を観察し、発生段階表を定義しました。観察の結果、レインボーフィッシュの胚発生後の鰭の発生は日齢や体サイズとはあまり相関せず、それぞれの鰭条の発生は背鰭の発生と同調しているようでした。そのため、鰭条の発生状態をもとに胚発生後の発生段階を4つに分類しました。私たちの研究成果は、レインボーフィッシュが棘鰭上目のモデル種として適していることを示しています。
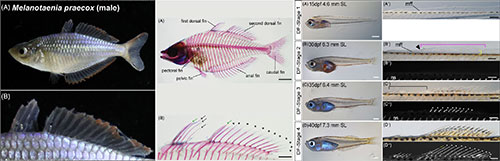
レインボーフィッシュの成魚の形態(左図)。第一背鰭と第二背鰭をもち、第一背鰭のすべてと第二背鰭の前端の鰭条が棘条、第二背鰭の残りの鰭条が軟条である。胚発生後のレインボーフィッシュの発生段階を鰭条の発生状態をもとに、DF-Stage1-4の4つに区分した(右図)。
Figure 1,2,6より改変。
真骨魚類の胸鰭の形態進化と多様性
Tanaka, Y., Miura, H., Tamura, K. and Abe, G. Morphological evolution and diversity of pectoral fin skeletons in teleosts. Zoological Letters. 2022, 8, 13. doi: 10.1186/s40851-022-00198-y, preprint at bioRxiv
真骨魚類は魚類のなかで最も多くの種が属するグループです。真骨魚類を含む脊椎動物の魚類は胸鰭と呼ばれる鰭をもっており、水中でのブレーキや方向転換を上手にこなすことができます。真骨魚類は水中の様々な環境に生息していますが、胸鰭を支える骨格のパターンにはあまり形態的な違いはないと考えられていました。本研究では、真骨魚類の胸鰭骨格の形の違いを明らかにし、さらにその進化の過程を同定するため、真骨魚類27種の胸鰭骨格を比較しました。その結果、真骨魚類の基盤的グループと派生的なグループのあいだで胸鰭骨格の進化が生じたことを明らかにしました。真骨魚類の骨格に関してこれまでに報告されているデータもあわせて考察すると、真骨魚類の胸鰭骨格要素には祖先的な魚類で見られる要素のうち、保存されている要素と保存されていない要素が混在していることが分かりました。本研究によって、真骨魚類の胸鰭が派生的な形態に進化するあいだに、近位短鰭骨の数や形の変化と保存、中烏口骨(mesocoracoid)の喪失、遠位担鰭骨と鰭条の接続関係の変化が起こったであろうことが明らかになりました。真骨魚類の進化の過程でどのような分子的あるいは遺伝的メカニズムの喪失や改変が起こってこれらの形態変化が駆動されたのかを明らかにすることは、胸鰭の真骨魚類特異的な進化を理解する鍵となると考えられます。
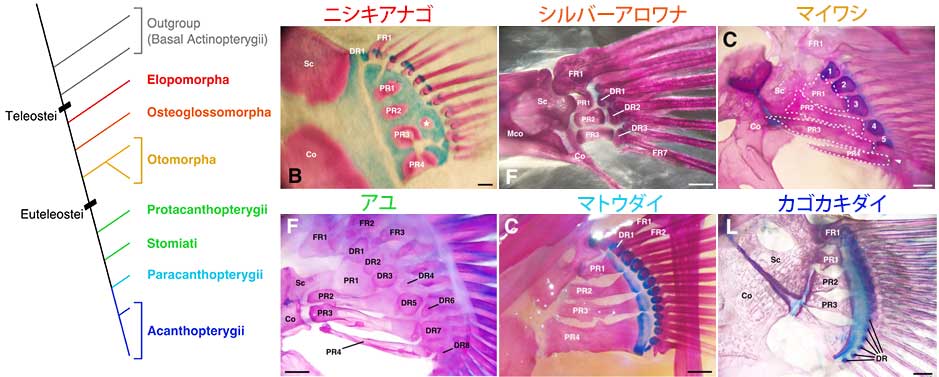
多くの真骨魚類で近位担鰭骨(PR)の数は4つに保存されているが、カライワシ上目(赤文字)の派生的系統に属するニシキアナゴやアロワナ上目(オレンジ)のシルバーアロワナなど一部の系統では数に変異がみられた。近位担鰭骨は基盤的な系統では長方形(シルバーアロワナ、マイワシ、アユ)、派生的系統では砂時計型/ダンベル型(ニシキアナゴ、マトウダイ、カゴカキダイ)である傾向がみられる。基盤的系統では遠位担鰭骨(DR)は複数の鰭条(FR)と接続する(シルバーアロワナ)が、派生的系統では1対1に接続(ニシキアナゴ、マトウダイ、カゴカキダイ)し、それらの接続関係が混在した系統もみられた(マイワシ、アユ)。
Figure 1-5より改変。
正中ヒレの進化的起源の定説を塗り替える新仮説:正中ヒレは仔魚の膜ヒレと独立に発生する
Miyamoto, K., Kawakami, K., Tamura, K. and Abe, G. Developmental independence of median fins from the larval fin fold revises their evolutionary origin. Scientific Reports. 2022, 12, 7521. doi: 10.1038/s41598-022-11180-1, プレスリリース
魚類の正中ヒレは、背ビレ、尾ビレ、尻ビレに分かれていますが、これらのヒレは、個体発生的にも系統発生的にも、一続きにつながった膜状構造に由来しています。これまで、仔魚に形成される膜ヒレの発生過程を観察した古典的な研究をもとに、「不連続な正中ヒレは原始的な脊索動物が持っていた一続きの膜ヒレが部分的に退縮することで進化した」とするMFF (median fin fold) 仮説が提唱されてきました。しかし、正中ヒレの発生過程は細胞・分子レベルではよく分かっていなかったため、今回、私たちはゼブラフィッシュの膜ヒレから正中ヒレへの転換過程を細胞・分子レベルで記載しました。その結果、膜ヒレの退縮は背ビレ原基の形成とは無関係であることが示されました。膜ヒレの退縮は(これまでMFF仮説で想定されていたように)ヒレの形成されない領域が細胞死によって積極的に取り除かれることによって起こるのではなく、背ビレ原基形成後に体が成長するのに伴って起こります。また、ある特定の間充織細胞の出現と増殖が背ビレ原基の形成を促していることも分かりました。これらの結果から、私たちは、正中ヒレの進化に関するこれまでの仮説を再考し、新規の発生メカニズムの獲得が不連続な正中ヒレ形態の進化に重要であることを提唱しました。
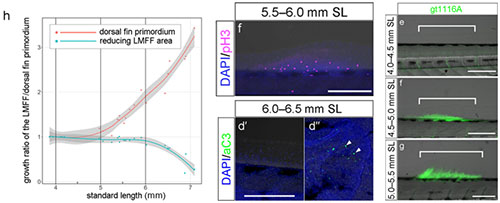
ヒレの高さを計測すると、背ビレの伸長(左図赤線)は膜ヒレの退縮(左図青線)に先立って起こることが分かる。背ビレが形成される領域では間充織細胞の増殖がみられる(中央上)一方、退縮する膜ヒレに細胞死はみられない(中央下d'、d"はコントロールとして尾部の細胞死を示す)。遺伝子トラップ系統gt1116Aを用いた解析では、背ビレが形成される領域にprdm16遺伝子を発現する間充織細胞が集積する様子が観察される。
Figure 1, 2, 4, 5より改変。
ニワトリ初代細胞培養システムにおける光による局所的な遺伝子発現誘導
Kitajima, K., Kawahira, N., Lee, S., Tamura, K., Morishita, Y. and Ohtsuka, D. Light-induced local gene expression in primary chick cell culture system. Development, Growth & Differentiation. Accepted Author Manuscript. doi: 10.1111/dgd.12721
組織培養や細胞培養を用いて研究を行うとき、培養する組織/細胞の特定の一部分に対して遺伝子操作を行うことは、その遺伝子の機能を解析する上で不可欠です。ニワトリの胚や細胞では、レトロウイルスやエレクトロポレーション、ソノポレーション、リポフェクションなどを用いた遺伝子導入法がすでに確立されています。しかしこれらの方法で、局所的な遺伝子発現を正確に誘導することは難しく、限界があります。そこで私たちは、ニワトリ初代細胞培養系において、近年開発された手法である光依存的遺伝子発現誘導システム(Light-Onシステム)を用いた効率的な局所的遺伝子導入方法を確立しました。このシステムでは、光刺激に応答して活性を変化させるアカパンカビNeurospora crassa由来の光受容器VividにGal4のDNA結合ドメインとp65の転写活性化ドメインを融合した人工タンパク質(GAVPO)を用います。このシステムにおいて、遺伝子の発現量と誘導の特異性は、光照射の条件に強く依存していました。なかでも、光の照射間隔は遺伝子発現の調節に重要なパラメーターであり、間隔が短いほど、誘導の特異性は高くなりました。また、単純に遺伝子を破壊あるいは導入するような実験とは異なり、このシステムでは光照射条件を調整することで遺伝子発現レベルを多段階に制御することができます。この結果は、光依存的遺伝子発現誘導システムが、ニワトリを用いたモデル系において、遺伝子発現レベルの段階的な変化がどのように遺伝子機能に影響するのかを調べる有用な方法となり得ることを示しています。その一つとして、私たちは、この光誘導システムを用いて、ニワトリ肢芽間充織細胞の培養系においてSox9の発現を制御し、誘導されたSOX9タンパク質が培養下でも下流遺伝子の発現を調節できることを示しました。
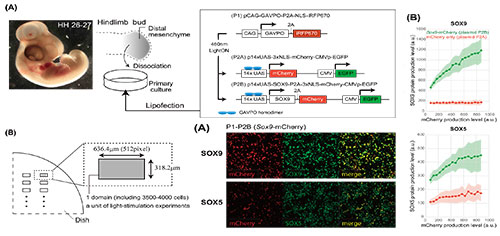
ニワトリ胚から肢芽先端部を切り出し解離した細胞をシャーレ上で高密度培養し、Light-Onシステム用のコンストラクトをリポフェクションにより導入する(左図A)。培養細胞の一部の領域に特定の「強さ」「時間」「間隔」で光照射を行うことで局所的に目的遺伝子を発現させる(左図B)。光照射によりSox9/mCherryを共発現させた細胞では、Sox9/mCherryの発現量に応じてSox9の下流遺伝子であるSox5が発現する(中央下図A、左図B)。
Figure 1, 3より改変。
鳥類始原生殖細胞の血管内への移動は、内皮細胞に囲まれることから始まる
Murai, H., Shibuya, M., Kishita, R., Sunae, C., Tamura, K. and Saito, D. Envelopment by endothelial cells initiates translocation of avian primordial germ cell into vascular tissue. Developmental Dynamics. 2021; 1– 10. doi: 10.1002/dvdy.332
脊椎動物において、卵や精子の前駆細胞である始原生殖細胞(PGCs: primordial germ cells)は、発生初期に生殖腺原基の外に形成された後、生殖腺原基まで移動することが知られています。鳥類の場合、PGCsは血管を通って生殖腺原基まで移動します。がん細胞の転移も同様に血流に乗って起こることから、PGCsの移動のメカニズムを明らかにすることは医学的にも有用であると考えられます。本研究において私たちはPGCsがいつ、どこで、どのように、血管ネットワークに入るのかを、血管の内皮細胞(ECs: endothelial cells)とPGCsを共に標識し、同時に観察することで明らかにしようと考えました。鳥類胚において、移動前のPGCsは胚の頭部前方から左右に弓状に広がる生殖三日月環と呼ばれる領域に出現します。一方、その時期には胚体外の血管域はまだ胚盤の最前部まで広がっておらず、内皮細胞は血管ネットワークを形成する前段階である血島を形成しています。この時期に最も前側の血管域と左右の生殖三日月環が重なる領域を観察すると、60%以上のPGCsが内皮細胞に囲まれていました。細胞形態の解析では内皮細胞がより活発に細胞膜に突起構造を形成している様子が観察され、PGCsと内皮細胞の相互作用では内皮細胞が主導的役割を果たしていることが示唆されました。発生が進むと、内皮細胞はPGCsを内部に含んだまま管腔を形成しました。その結果、成熟した血管ネットワークの血管内腔には多くのPGCsが含まれることになります。これらの結果は、鳥類のPGCsが血管内へ移動する方法のなかで、がん細胞の転移で見られるような血管内への侵入(intravasation)は主要な方法ではなく、初期血管形成期の内皮細胞による囲い込み(envelopment)という受動的な移動方法が主に用いられていることを示しています。
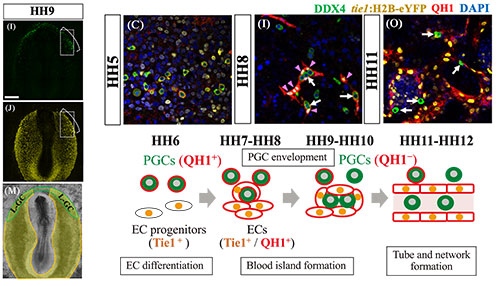
ウズラ胚のPGCsの分布(左図上)と内皮細胞の分布(左図中央)が重なった領域(左図下)を観察した結果を、画像(右図上)と模式図(右図下)に示した。これらの図で示すように、発生が進むにつれて、PGCs(緑)は内皮細胞(黄)に囲まれ、その結果、血管ネットワークに取り込まれる。興味深いことに、PGCsは発生初期にはQH1抗体陽性であるが、発生が進むにつれて陰性となる。一方ではじめQH1抗体陰性の内皮細胞は分化が進むにつれてQH1陽性となるが、どちらの細胞もQH1抗体陽性の時期に、内皮細胞によるPGCsの囲い込みが始まるように見える。
Figure 1, 2, 7より改変。
サリドマイドとその代謝物はセレブロンの新規基質PLZFを介して催奇性を引き起こす
Yamanaka, S., Murai, H., Saito, D., Abe, G., Tokunaga, E., Iwasaki, T., Takahashi, H., Takeda, H., Suzuki, T., Shibata, N., Tamura, K. and Sawasaki T. Thalidomide and its metabolite 5‐hydroxythalidomide induce teratogenicity via the cereblon neosubstrate PLZF. The EMBO Journal. 2021, e105375. doi: 10.15252/embj.2020105375, プレスリリース
サリドマイドは、基質特異的にタンパク質を分解するユビキチンリガーゼの構成因子であるセレブロン(CRBN)を介して催奇性を引き起こします。サリドマイドはP450シトクロム(CYP450s)によってヒドロキシル化(水酸化)された代謝物として作用すると考えられていますが、そのメカニズムには未解明な部分がまだ多く残されています。本研究で私たちは、PLZF(promyelocytic leukaemia zinc finger, ZBTB16とも呼ばれる)がCRBNの標的タンパク質であり、その分解がサリドマイドもしくはその代謝物である5位水酸化サリドマイドの催奇性に関与していることを示しました。私たちは、コムギ無細胞タンパク質合成系によって構築されたヒト転写因子プロテインアレイを用いて、サリドマイド依存的なCRBNの基質としてPLZFを同定しました。PLZFはサリドマイドやその誘導体、あるいは5位水酸化サリドマイドと結合したユビキチンリガーゼ複合体CRL4CRBNによって、PLZFに保存された2つのZnフィンガードメイン(ZNF1, ZNF3)依存的に分解されます。驚くべきことに、サリドマイドと5位水酸化サリドマイドはマウスとニワトリで明らかに異なる基質特異性を示し、ニワトリ胚ではどちらの化合物も催奇性を引き起こします。同様に、ニワトリ胚においてPlzf遺伝子をノックダウンした場合にも四肢の骨が短くなる異常が起こりました。ここでもっとも重要なことは、サリドマイドや5位水酸化サリドマイドを処理したニワトリ胚において誘導されたのは、既知のサリドマイド依存的なCRBNの基質であるSALL4の分解ではなく、PLZFの分解であるということです。さらに、PLZFの過剰発現によってサリドマイドにより誘導された表現型が一部レスキューされることも分かりました。これらの結果は、PLZFが、サリドマイドに誘発されるCRBNの新規基質として、サリドマイドの催奇性に関わっていることを示唆しています。
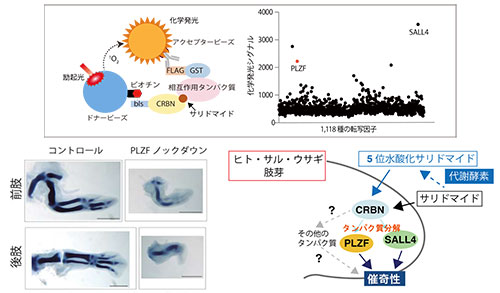
コムギ無細胞系によって合成されたタンパク質を⽤いた相互作⽤解析 (上図左)と、ヒト転写因⼦プロテインアレイを⽤いた網羅的な相互作⽤解析(上図右)の結果、PLZFが同定された。ニワトリ胚においてPlzf遺伝子をノックダウンすると、四肢の骨格が短くなる(左下図)。ニワトリではサリドマイドは肢芽のSALL4タンパク質分解を誘導しないが、ヒトなどのサリドマイドに対して⾼い感受性を⽰す⽣物種では、サリドマイドと5位⽔酸化サリドマイドの両⽅が、四肢形成に必須なPLZFとSALL4のどちらのタンパク質の分解も誘発するため、強⼒な催奇性が引き起こされると考えられる(右下図)。
プレスリリースより改変。
ゼブラフィッシュ胸鰭の内骨格は、成体では再生しないが発生初期には再生できる
Yoshida, K., Kawakami, K., Abe, G. and T., Tamura, K. Zebrafish can regenerate endoskeleton in larval pectoral fin but the regenerative ability declines. Developmental Biology. 2020, 463, 110-123. doi: 10.1016/j.ydbio.2020.04.010
本研究で私たちは、ゼブラフィッシュの発生中の胸鰭において内骨格が再生することを初めて示しました。胸鰭の発生過程では、分化した軟骨細胞が板状に凝集した軟骨板(endochondral disc)が形成され、これが鰭の付け根の内骨格要素である近位担鰭骨の原基となります。この軟骨板の半分を切除すると、切除した部分は再生し、もとの内骨格パターンと同等のパターンを再び形成しました。また再生の初期過程を観察したところ、鰭の初期発生で内骨格原基の成長に重要な上皮構造である外胚葉性頂堤(AER)の分子マーカーが切除後の切断面を速やかに覆う上皮で発現していること、切断面の間充織細胞が活発に増殖を始めることが分かりました。さらに、再生芽マーカー遺伝子のオーソログであるmsxbや他の発生関連遺伝子が再発現することを考え合わせると、軟骨板の再生は、付加再生である四肢の再生過程と同様に、鰭の発生過程をなぞっていると考えられます。発生が進むにつれて胸鰭の内骨格の再生能力は低下し、成体のゼブラフィッシュでは再生能力は遂に失われて、骨格は再生せず切除後に残された内骨格がただ肥大するだけになります。このように発生過程で異なる再生能力をもつゼブラフィッシュの胸鰭内骨格の再生は、哺乳類の四肢再生能力の獲得にむけて、再生研究の新しいモデルとなるシステムと考えられます。
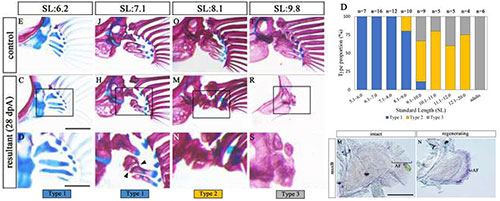
左図はそれぞれの発生段階(SL: Standard Length)で胸鰭内骨格を切除して28日後の骨格パターンを示す。切断していない反対側の胸鰭の正常な骨格パターン(写真上)と比較して、近位担鰭骨が再生したものをType 1、骨格の一部は再生するが近位担鰭骨が再生しないものをType 2、骨格要素の再生がないものをType 3に分類し、右図上で示すグラフにまとめると、胸鰭内骨格は発生初期には再生すること、再生能力は発生が進むにつれて減少することが分かる。右図下に示すように、発生初期の胸鰭を切断すると切断3日後に再生芽マーカーのmsxbが発現することから、胸鰭内骨格の再生は両生類などの四肢の付加再生と同様の現象であることが示唆される。
Figure 2, 3, 6より改変。
ゼブラフィッシュの尾鰭の再生において、鰭がどれくらい再成長するのかは切断された鰭の長さで決まる
Uemoto T., Abe, G. and T., Tamura, K. Regrowth of zebrafish caudal fin regeneration is determined by the amputated length. Scientific Reports. 2020, 10, 649. doi: 10.1038/s41598-020-57533-6, プレスリリース
魚類は尾鰭などの鰭を再生する高い能力をもっています。双葉型の尾鰭を切断すると、尾鰭は素早く再成長して、もとの双葉型の形に戻ります。このとき、切断された尾鰭の傷口には再生芽細胞が形成され、この再生芽細胞が新たな尾鰭の形態形成を司ります。イモリなどの両生類の四肢の再生では、基部先端部軸に関して同じ位置(例えば膝の位置)で形成された再生芽細胞はその同じ位置を記憶している(位置記憶: positional memory)ことが知られていますが、魚類の尾鰭の再生芽細胞が果たして両生類の四肢再生のときと同じように位置記憶をもっているのかについては論争があります。ゼブラフィッシュの尾鰭は双葉型をしており、尾鰭を同じ基部先端部軸レベルで直線的に切断した場合、もとの双葉型に戻るためには1本1本の鰭条はそれぞれ違う長さで再形成される必要があります。そこで私たちは、尾鰭の再生における鰭条ごとの再生期間と成長速度を調べました。すると、再生が終了するまでにかかる期間も成長速度も鰭条によって異なることが分かりました。また、より基部側で(深い位置で)切断したほうが、より先端部で(浅い位置で)切断するよりも、もとの形/大きさに戻るのに長い期間が必要であることも分かりました。これらの結果を統計的に解析すると、鰭条の位置(双葉型のふくらみや凹みのどの位置か)や切断の深さに関わらず、すなわち、鰭条の背腹軸、基部先端部軸とは独立して、「切断された鰭条の長さ」が再生期間と成長速度を決めていることが示唆されました。さらに、薬物投与実験を行い、切断位置の鰭条の太さのような構造的/物理的条件が再生期間と成長速度を決めるニッチを作り出していることを示唆する結果を得ました。
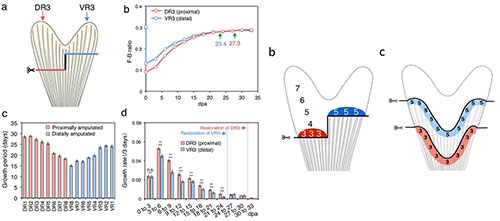
左図aのように尾鰭を基部先端部軸の2つのレベルでジグザクに切断すると、より浅く切断した鰭条のほうが先に元の長さに戻る(左図b, 長さには体長で補正した値であるF-B ratioを用いている)。鰭条ごとの再生期間は切断された鰭条の長さと相関するようにみえ(左図c)、もとの長さがほぼ同じ鰭条(DR3, VR3)を比較すると、より深く切断した鰭条(DR3)の方が再生速度が速いことが分かる(左図d)。この結果は鰭の再生芽細胞の位置価に関する一般的なモデル(左図b)とは合致せず、切断された鰭の長さ(先端部からの距離)が同じ位置に、同じニッチが存在すると考えるとよく説明できる(左図c)。
Figure 1, 4より改変。
鰭条と遠位担鰭骨の接続様式に基づく鰭条の前後軸パターン
Hamada, H., Uemoto, T., Tanaka, Y., Honda, Y., Kitajima, K., Umeda, T., Kawakami, A., Shinya, M., Kawakami, K., Tamura, K. and Abe, G. Pattern of fin rays along the antero-posterior axis based on their connection to distal radials. Zoological Letters. 2019, in press. doi: 10.1186/s40851-019-0145-z, PubMed
真骨魚類の対鰭の骨格は、外骨格の鰭条(fin rays)と内骨格の担鰭骨(radials)に分けられます。このうち内骨格の担鰭骨は、同じく内骨格である四足動物の四肢の骨格要素と相同であると考えられており、胚発生の過程で前後軸(親指-小指方向の軸)に沿った骨格パターンが形成されるメカニズムについても、四肢と同様のメカニズムがはたらいていると考えられています。一方で、外骨格である鰭条の前後軸パターンの形成については、四肢や鰭の内骨格部分の発生メカニズムとの共通性を指摘するいくつかの報告はあるものの、個体ごとに鰭条本数にばらつきがあるなどの理由で明瞭なパターンはないだろうと考えられてきました。本研究では、まず鰭条について、とくに遠位の担鰭骨(distal radials)との接続部に着目して形態観察を行い、それをゼブラフィッシュの系統内および系統間で比較しました。その結果、鰭条の本数は個々の胸鰭ごとに変動があること、鰭条と遠位担鰭骨の接続の仕方は前後軸に沿って異なっており、それをもとに胸鰭を3つの領域にカテゴリー分けできること、さらに後ろ側の領域の鰭条の本数のゆらぎが鰭全体の鰭条本数の変動に繋がっていることが明らかになりました。また、発生過程で遠位担鰭骨が鰭条の根元に局在する様子を観察すると、遠位担鰭骨の局在様式は胸鰭の前方と後方で異なっており、中央の領域でそれが切替わっているのが観察されたました。このことは、この局在様式の変化が鰭条の本数の変動に関係していることを示唆します。最後に私たちは、四肢において前後軸方向のパターン形成に関わっているlhx遺伝子が、鰭条と遠位担鰭骨の発生過程においても発現していることを確かめました。このように、鰭条とそれが内骨格へと接続する様式は前後軸にそって異なっており、そのパターンはこれまで報告されてきた四肢や胸鰭内骨格の前後軸パターンと同様の発生メカニズムによって形作られているようです。これらの結果から私たちは、鰭条の形成と遠位担鰭骨との接続の発生メカニズムは、四肢の先端部(手のひらや指など)の骨格要素の形成やその基部との接続のメカニズムに相当するものとして位置づけるられるのではないかと考えています。
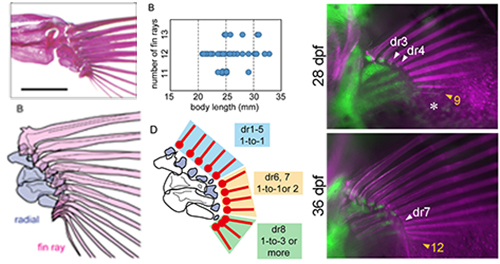
ゼブラフィッシュの胸鰭は鰭条(fin rays)と担鰭骨(radials)に分けられる(左)。鰭条の数は胸鰭ごとに変動があり、それは魚の大きさとは関係がない(中央上)。鰭条と遠位担鰭骨のとの接続様式によって、胸鰭を前後軸にそった3つの領域に分けることができる(中央下)。発生過程において、前側の遠位担鰭骨は鰭条の根元に局在するが、後ろ側の遠位担鰭骨は近位担鰭骨の先端から現れる(右)。
Figure 1, 2, 4より改変。
恐竜型の股関節を獲得するための形態形成メカニズム
Egawa, S., Saito, D., Abe, G. and Tamura, K. Morphogenetic mechanism of the acquisition of the dinosaur-type acetabulum. Royal Society Open Science. 2018, 5: 180604. doi: 10.1098/rsos.180604, PubMed
恐竜の形態がどのように進化したのか、そのメカニズムを理解するためには、恐竜になって初めて現れた形質(派生形質)がどのように作られたのかを知る必要があります。股関節が大腿骨と間接する部分は寛骨臼(かんこつきゅう)と呼ばれていますが、この寛骨臼に穴が開いているという特徴も、恐竜の出現とともに獲得された形態のひとつであり、この形態は直立型の歩行をする恐竜の運動機能に深く関わっています。私たちは、恐竜の子孫であり恐竜型寛骨臼をもつ鳥類と、祖先型の(穴の開いていない)寛骨臼をもつヤモリとカメのそれぞれの発生中の胚を用いて、恐竜型の寛骨臼がどのように形成されるのかを調べました。まず、これらの動物胚の寛骨臼の発生過程を比較すると、鳥類の寛骨臼の穴は、一旦形成された軟骨組織が二次的に消失することで形成されることが分かりました。また、器官培養系を用いて組織間相互作用を調べたところ、関節形成期に現れるインターゾーンと呼ばれる間充織組織が、この軟骨の消失に関わっていることが示唆されました。さらに、鳥類の骨盤の原基は祖先型の爬虫類の原基よりもインターゾーンで分泌されるWntなどの分子に対する感受性が高いことも分かりました。これらの結果から私たちは、恐竜が出現したときに、恐竜の骨盤原基のWntに対する感受性が高まったため、それが関節部分の軟骨組織の消失を引き起こし、寛骨臼領域に穴が開くようになったのではないかと考えています。今回の私たちの進化発生生物学研究は、恐竜の形態進化に対する理解を深めるものであるとともに、恐竜研究に新たな方向性を与えるものです。
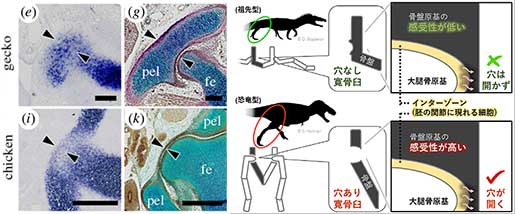
ヤモリでは寛骨臼領域に形成された軟骨組織はそのまま発生し穴は開かない(左図e,g)が、ニワトリの寛骨臼領域では一旦軟骨組織が作られる(左図i)が、発生が進むと消失し穴が開く(左図k)。インターゾーンが産生するシグナル分子に対する骨盤原基の感受性が上昇したことで、恐竜型の寛骨臼が形成された(右図)。
Figure 1, プレスリリースより改変。
風切羽の特徴的な形態は胚発生期に作られる
Kondo, M., Sekine, T., Miyakoshi, T., Kitajima, K., Egawa, S., Seki, R., Abe, G. and Tamura, K. Flight feather development: its early specialization during embryogenesis. Zoological Letters. 2018, 4:2. doi: 10.1186/s40851-017-0085-4, PubMed
風切羽は、鳥がもつ羽毛のなかで最も高度に進化した羽毛です。一般的に、鳥のヒナは孵化直後ふわふわの幼綿羽で覆われており、それが換羽することで成鳥の羽毛が形成されます。ニワトリでは、その1回目の換羽は孵化後およそ2週間で起こりますが、過去の報告から風切羽の形成は孵化前の胚発生期から起こっていること(1回目の換羽が胚発生期に始まること)が示唆されていました。そこで私たちは、風切羽形成の開始時期を特定するとともに、他の羽毛と異なる風切羽の特徴的な形態形成過程について明らかにしたいと考えました。ニワトリ胚の形態観察の結果、孵化前の18日胚までに、将来風切羽が形成される領域の皮膚深くに風切羽の特徴をもった羽毛が形成され始めていることが分かりました。また、その羽は14日胚までに形成されはじめることが、shh遺伝子の発現から確認できました。さらに遡って羽毛原基の形態を観察すると、まだ風切羽の羽毛原基が幼綿羽を形成している11日胚の段階で、風切羽の羽毛原基はすでに皮膚の内側に陥入し始めていることが分かりました。成鳥の風切羽の羽軸は骨に届くほど深く陥入していますが、その特徴的形態がすでに11日胚で見られることを示しています。このように、最も進化した羽毛である風切羽は、形態形成の開始からすでにその発生様式を大きく変化させていることが分かりました。胚発生期に起こるこの変化が、風切羽という鳥類進化の鍵となる形質の進化に重要な役割を果たしたことが示唆されます。私たちは、四肢の軸形成に関わる分子メカニズムが転用(co-option)されてこの羽毛原基の形態形成の特殊化が起こり、風切羽の形態的な特徴が新たに生じたのではないかと考えています。
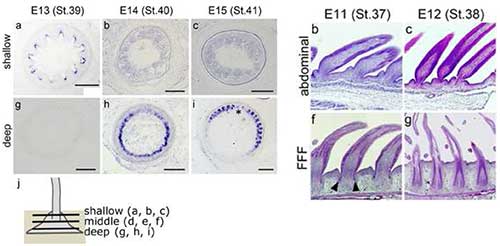
羽毛発生において羽枝の間の細胞死領域に発現するshhの発現から、13日胚の風切羽領域の羽毛原基では、浅い領域に放射相称の羽枝をもつ幼綿羽の原基が形成されていることが分かる(右図A)。14日以降になると幼綿羽のshh発現は消失し、より深い領域にある次の羽毛の原基(左右非相称の羽枝をもつ風切羽の特徴をもつ)で発現を開始する(右図h,i)。また、体幹腹部で綿羽をつくる羽毛原基(左図上)と異なり、風切羽領域の羽毛原基(左図下)は、11日胚の段階で皮膚深くに陥入し始める。
Figure 4, Figure 5より改変。
ニワトリ肢芽においてshh遺伝子が局所的発現を開始するメカニズム
Matsubara, H., Saito, D., Abe, G., Yokoyama, H., Suzuki T., and Tamura, K. Upstream regulation for initiation of restricted Shh expression in the chick limb bud. Developmental Dynamics, 2017, in press. doi: 10.1002/dvdy.24493, PubMed
organizing center(形成体)は、モルフォゲン(濃度勾配によって細胞の発生運命を決める物質)の産生源であり、動物の形態形成に非常に重要な役割を果たしています。形態形成の"場"においてorganizing centerが適切に機能するためには、それが作用する"場"の一部分に限局して存在する必要があります。四肢の前後軸方向の形態形成におけるorganizing centerである極性化活性帯(ZPA: zone of polarizing activity)は、肢芽の後端部に限局して存在し、shh遺伝子を特異的に発現しています。肢芽の前後軸は、肢芽の前側に発現するGli3遺伝子や後側で発現するHand2遺伝子によってまずは大まかに決められますが、これらの発現だけではshhが肢芽の後端部に小さなスポット状に発現を開始することを説明することはできません。私たちは、shhの限局した発現がどのように開始するのかを明らかにするため、shhの発現制御に関わるいくつかの候補分子について、shh発現の開始時期の肢芽における発現の状態を調べ、shhの発現と比較しました。その結果、shhの上流で作用するFgf8、Hoxd10、Hoxd11、Tbx2、Alx4の発現の組み合わせが、shhの局所的な発現の開始に関わっている可能性が示されました。機能解析の結果も合わせて、私たちは、これらの遺伝子による促進的あるいは抑制的な転写制御ネットワークの結果として、それらの発現が交わる点を境界とするようにZPAが限局し、そこでモルフォゲンであるshhの発現が開始されるというモデルを提唱しました。
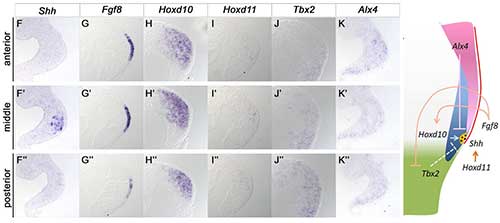
shh発現開始直後、AERにおけるfgf8の発現の後端(左図G)はshhの発現の後端(左図F)とほぼ一致する。この時期Hoxd10はshhの発現より広い領域で肢芽後端に発現する(左図H)一方、hoxd11はshhと重なる領域で弱く発現する(左図I)。また、shh発現前にはTbx2とAlx4は肢芽全体に発現がみられるが、Tbx2は肢芽中央部からshh発現領域にかけて(左図J)、Alx4は肢芽の後端からshh発現領域にかけて(左図K)発現が弱まり、shhはこれらの遺伝子発現が弱まったところで発現する。これらの発現と遺伝子機能解析の結果からshh遺伝子の発現開始領域が限局するメカニズムについて、モデルを提唱した(右図)。
Figure 3, Figure 8より改変。
鳥類の大進化には、鳥特異的なシス制御領域が深く関わっている
Seki, R., Li, C., Fang, Q., Hayashi, S., Egawa, S., Hu, J., Xu, L., Pan, H., Kondo, M., Sato, T., Matsubara, H., Kamiyama, N., Kitajima, K., Saito, D., Liu, Y., Gilbert, M.T.P., Zhou, Q., Xu, X., Shiroishi, T., Irie, N., Tamura, K., and Zhang, G. Functional roles of Aves class-specific cis-regulatory elements on macroevolution of bird-specific features. Nature Communications, 2017, 8, 14229. doi: 10.1038/ncomms14229, プレスリリース, PubMed
鳥類や哺乳類など綱(class)レベルの大きな分類群を新たに生じるような大進化の過程は、種(species)分化のような小進化の過程とは異なり、これまでよく分かっていませんでした。大進化の注目すべき事例のひとつに、(非鳥類型の)恐竜から鳥類への進化があります。その進化の過程で鳥は、自力飛翔を可能にする風切り羽のある翼など、多くの形質を新たに獲得しました。今回私たちは、この鳥類進化の過程で鳥のゲノムに起こった変化を明らかにするため、48種の鳥のゲノムから、鳥類だけに高度に保存された配列(ASHCEs , avian-specific highly conserved elements)を数多く同定し、そのほとんど(99%以上)が構造遺伝子以外の配列であることを明らかにしました。四肢の発生過程におけるASHCEsのヒストン修飾状態の解析からは、その多くがヒストン修飾を受けており、四肢の発生過程ではたらいていることが示唆されます。さらに、ASHCEs近傍の(ASHCEsに制御されている可能性がある)遺伝子の発現状態を鳥類と鳥類以外の四足動物で比較したところ、四肢の発生過程でASHCE近傍の遺伝子が鳥類のみで独自のはたらきをもっている可能性があることが示されました。なかでも、Sim1遺伝子は、ASHCEにより発現が制御され、風切り羽の発生と進化との関連を示唆するような鳥特異的な発現を示しました。これらの発見は、鳥類特異的な形質の獲得にASHCEsが関わっていること、さらには、このようなシス制御領域の「書き換え」が大進化の過程に重要な役割を果たしていることを示しています。
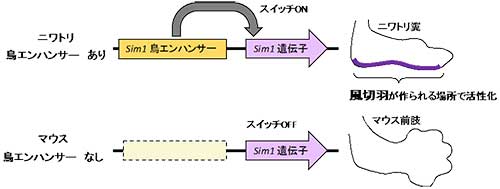
鳥類はSim1遺伝子近傍に鳥類でよく保存された共通配列(ASHCE)をもち、エンハンサーとして機能しているが、マウスにはその配列は存在しない。Sim1鳥エンハンサーのはたらきによって、鳥類ではSim1遺伝子が将来風切り羽が形成される領域で発現する。
プレスリリースより抜粋。
赤外線レーザー顕微鏡および温冷負荷装置による局所遺伝子発現技術の両生類再生研究への応用
Kawasumi-Kita, A., Hayashi, T., Kobayashi, T., Nagayama, C., Hayashi, S., Kamei, Y., Morishita, Y., Takeuchi, T., Tamura, K. and Yokoyama, H. Application of local gene induction by infrared laser-mediated microscope and temperature stimulator to amphibian regeneration study. Development Growth and Differentiation, 2015, 57, 601-613. doi: 10.1111/dgd.12241, PubMed
四足動物のなかでも両生類は極めて高い再生能力を持つことから、立体的な器官の再生メカニズムを解明するための優れた研究モデルとなっています。しかし両生類の器官再生の分子メカニズムを研究するとき、目的とする領域の細胞への局所的な遺伝子発現操作が困難であることが障害となっていました。最近になって、硬骨魚類、線虫、ショウジョウバエ、あるいは植物において、レーザー照射による局所的なヒートショック(熱刺激)により遺伝子を局所的に(単一細胞レベルでさえも)誘導できるようになってきました。本研究では、アフリカツメガエルとイベリアトゲイモリという2種類の両生類について、ヒートショックプロモーターで遺伝子発現が誘導されるトランスジェニック動物に対して、赤外線レーザー照射により局所的なヒートショックを与えるという方法(IR-LEGO)で、目的とする領域だけに遺伝子発現を誘導することに成功しました。さらに私たちは、アフリカツメガエルの幼生と仔ガエルに対して、専用の温冷負荷装置を用いて温度を制御した金属プローブを当てるという方法で局所的なヒートショックを与え、IR-LEGOよりもより広い範囲に局所的な遺伝子発現を誘導しました。これらのIR-LEGOおよび温冷負荷装置による局所的遺伝子操作技術を両生類の再生研究に応用することで、非特異的な影響を軽減したうえで目的の領域もしくは細胞における遺伝子機能の解析を行うことができるだけでなく、Cre-LoxPシステムとの組み合わせによる、より厳密な細胞系譜追跡も行うことが可能となります。
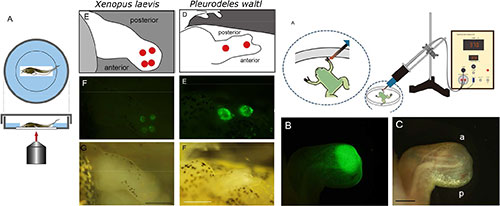
IR-REGO法(左図左)を用いると、アフリカツメガエル(左図中央)とイベリアトゲイモリ(左図右)の肢芽の任意の位置に局所的な遺伝子発現を誘導することができる。一方、温冷負荷装置(右図上)を用いてアフリカツメガエルの仔ガエル再生芽に遺伝子を誘導すると、IR-REGO法よりも広範囲で局所的な遺伝子発現を誘導できる(右図下)。
Figure 2, Figure 3, Figure 5より改変。
転写調節因子AP-2βは四足動物の指の長さの決定に関与する
Seki, R., Kitajima, K., Matsubara, H., Suzuki, T., Saito, D., Yokoyama, H. and Tamura, K. AP-2β is a transcriptional regulator for determination of digit length in tetrapods. Developmental Biology. 2015, 407, 75–89. doi: 10.1016/j.ydbio.2015.08.006, PubMed
四足動物の指は動物種によってさまざまな形態をもち、種ごとに指骨や中手骨(掌の骨)、手根骨(手首の骨)の長さや数も異なります。このような種特異的な形態は、四足動物に共通する指の発生メカニズムが、種ごとに異なる修飾をされることで形成されると考えられます。今回、私たちは、転写調節因子AP-2βがニワトリの自脚部(手首から先の部分)において指の長さを調節する機構を調べました。AP-2βをコードする遺伝子の変異はChar 症候群とよばれるヒトの自脚部の優性遺伝子疾患を引き起こす原因となっています。Char 症候群の患者には指骨の欠損や指の短縮などの骨形成不全がみられ、このことはAP-2βが正常な指の長さの決定に関わることを示唆しています。ニワトリ胚において、ヒトのChar 症候群でみられる2種類の変異型AP-2βと同じ変異をもつドミナントネガティブ型AP-2βを、それぞれ後肢の肢芽で異所的に発現させると、指骨や中足骨の数の減少や長さ短縮などの指の形成不全が引き起こされました。また、3種の羊膜類(ニワトリ、マウス、ヤモリ)の肢芽におけるAP-2βの発現パターンを詳細に解析したところ、四肢の間充織におけるAP-2βの発現パターンや発現時期と、3種の動物それぞれの指の長さとの間に相関があることが示されました。さらに私たちは指の形態形成に重要な上皮構造であるAERからのFgfシグナルの下流にAP-2βがあること、AP-2βの機能亢進が指の長さ調節を阻害することを示しました。これらの結果から、AP-2βが指の形態形成に関わる転写調節因子として機能していることが明らかになりました。
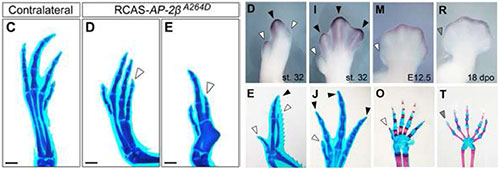
ドミナントネガティブ型AP-2βの異所的発現は、指の形成不全を引き起こす(左図C-E)。また、ニワトリ前肢(右図D,E)、後肢(I,J)、マウス前肢(M,O)、ヤモリ前肢(R,T)において、AP-2βの指先端部における発現(上段)が強い指ほど、指が長さ(下段)が長い傾向がみられた。
Figure 1およびFigure 3より改変。
ツメガエルの肢芽再生において、エピジェネティックな修飾が四肢の細胞に内在するアイデンティティーを維持している
Hayashi, S., Kawaguchi, A., Uchiyama, I., Kawasumi-Kita, A., Kobayashi, T., Nishide, H, Tsutsumi, R., Tsuru, K., Inoue, T., Ogino, H., Agata, K., Tamura, K. and Yokoyama, H. Epigenetic Modification Maintains Intrinsic Limb-Cell Identity in Xenopus Limb Bud Regeneration. Developmental Biology, 2015, 406, 271–282. doi: 10.1016/j.ydbio.2015.08.013, PubMed
両生類の多くは、成体になった後でも四肢を再生することができます。四肢を切断すると、残された切断部位から再生芽が生じ、再生芽は発生過程とよく似た形態形成の過程を経て新しい完全な肢を形成します。再生芽は、切断部位の細胞がもっていた四肢のパターン形成に関する特性を引き継いでおり、発生にともなって形態や遺伝子発現、分化状態が変化した後も、四肢再生に必要な情報を維持していると考えられます。私たちはこのような細胞の特性が、ヒストン修飾を介してエピジェネティックに記憶、維持されていると考えて、その仮説を検証するため、ツメガエルの肢芽再生におけるヒストン修飾の全ゲノム解析を行いました。ヒストンH3は、4番目のリジンがメチル化される(H3K4me3)とクロマチン構造が開いて転写因子が遺伝子に作用しやすくなります。一方、27番目のリジンがメチル化される(H3K27me3)と、クロマチン構造が閉じて転写が不活性化します。そこで、クロマチン免疫沈降後にハイスループットDNAシーケンシングを行うという手法を用いて、ゲノム全体でのこの2つのヒストン修飾の状態を発生中の肢芽と再生芽で比較しました。その結果、発生に関わる多くの遺伝子において、転写開始部位におけるヒストン修飾状態は肢芽と再生芽で同一であり、その状態は再生過程を通して安定していること、また四肢の特性ともよく合致していることが分かりました。ツメガエル肢芽の再生過程では、遺伝子発現が大きく変化する一方で、四肢の細胞の特性を維持するための細胞記憶が保持される必要がありますが、今回の結果は、そこにヒストン修飾が関わっていることを示唆しています。
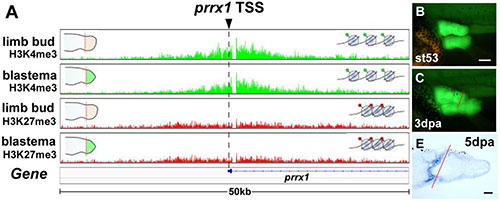
ネッタイツメガエルのステージ53の肢芽(limb bud)とそれを切断後7日目の再生芽(blastema)において、prrx1 (prx1)遺伝子の転写開始部位近傍にH3K27me3の大きなピークはないが、H3K4me3の高いピークがみられる(図A)。この結果は四肢の発生と再生においてprrx1が特異的に発現するというこれまでの報告と一致する。一方、prrx1のmRNAは再生初期には再生芽全体で発現する(図B,C、Suzuki et al., 2005, 2007)がその発現状態は大きく変化し、(切断後7日目でもH3K4me3の高いピークは維持されているにもかかわらず)肢芽切断後5日目には切断部近傍に限局して発現する(図E)。
Figure 5より改変。
両生類に6番目の指があることを示す証拠
Hayashi, S., Kobayashi, T., Yano, T., Kamiyama, N., Egawa, S., Seki, R., Takizawa, K., Okabe, M., Yokoyama, H. and Tamura, K. Evidence for an amphibian sixth digit. Zoological Letters. 2015, 1:17. doi: 10.1186/s40851-015-0019-y, PubMed
四足動物はその生活環境に適応して様々な形態の指を持ちますが、現生の四足動物の指の数は5本もしくは(退化して)それ以下の本数であるとされており、これをpentadactyl constraint(5指性制約)といいます。ところが私たちは、両生類の一種であるネッタイツメガエルXenopus tropicalisの後足第1指の前腹側に、ツメをもった突起があることに気が付きました。そこで、この突起が何であるかを調べるため、その形態や組織構成、発生とその過程における遺伝子発現を調べました。その結果、ネッタイツメガエルがもつこの突起は6番目の指であることを示す証拠が、その解剖学的性質や発生過程における分子マーカーの発現などから示されました。今回、ネッタイツメガエルの6番目の指が同定されたことは、よく似た形態をもつ他のツメガエル類においてこの6番目の指と同じ位置にみられる前母趾(prehallux、後肢第1指の前側にみられる突起)もまた、指の痕跡であることを強く示唆しています。前母趾はツメガエルに限らず両生類の様々な種に広くみられる構造ですが、私たちは、両生類の前母趾はどれも痕跡的な6番目の指なのではないかと考えています。

ネッタイツメガエル(X. tropicalis)成体の後肢第1指の前腹側にはツメをもった突起があり、突起には2つの骨要素が含まれる(左図A,J)。一方、アフリカツメガエル(X. laevis)成体の同じ場所にも、ツメはないものの2つの骨要素から成る突起がある(左図E,L)。ネッタイツメガエルのこの突起の先端側の骨要素には、先端側の指骨と同様に筋肉(右図B蛍光緑)は付着しておらず腱が直接付着している(右図E矢印)。
Figure 1およびFigure 3より改変。
アフリカツメガエル幼生の尾の再生において、Hippoシグナル経路の転写調節因子は器官の成長を制御する
Hayashi, S., Ochi, H., Ogino, H., Kawasumi, A., Kamei, Y., Tamura, K. and Yokoyama, H. Transcriptional regulators in the Hippo signaling pathway control organ growth in Xenopus tadpole tail regeneration. Developmental Biology, 2014, 396, 31–41. doi: 10.1016/j.ydbio.2014.09.018, PubMed
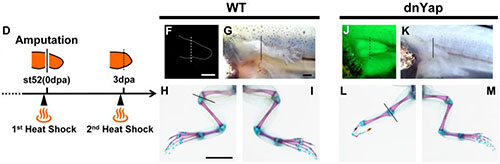
器官形成において、組織のサイズや形は、細胞や組織で同時に起こる様々な過程によって厳密に制御されています。その制御機構のひとつであるHippoシグナル経路は、抑制的なキナーゼカスケードを介して2元的に調節されるシグナル伝達の状態によって、細胞増殖とアポトーシスの両方を制御しています。Yap1とTeadはHippoシグナル経路の下流で作用する転写調節因子であり、細胞増殖の調節に必須の役割を果たしています。両生類の四肢や尾を再生させると、組織は切断部で局所的に成長しますが、その成長は再生組織がその器官の正常なサイズに達したときに終了します。このことは、器官レベルの付加再生が起こるときにも器官のサイズが厳密に制御されていることを示唆しています。私たちは最近、Yap1がアフリカツメガエル幼生の肢芽の再生に必要であることを示しました(Hayashi et.al., 2014)が、脊椎動物の付加再生においてHippo経路と組織サイズが分子レベルでどのように関連しているのかについてはまだよく分かっていませんでした。そこで私たちは、付加再生とそれに伴う器官サイズ制御においてHippo経路の転写調節因子の必要性を調べるため、ヒートショックプロモーターにドミナントネガティブ型のYap (dnYap)とTead4 (dnTead4)をそれぞれ繋いだトランスジェニックガエルを作成し、ツメガエル幼生の尾の再生時にそれらを過剰発現させることで、YapとTead4の作用をそれぞれ阻害しました。その結果、どちらの阻害実験においても尾の再生は阻害され、細胞増殖の減少とアポトーシスの増加が見られました。単一細胞での阻害実験から、Tead4は再生している尾の神経前駆細胞の生存を細胞自律的に制御していることが示されました。両生類では基部側で(深く)切断した尾は、先端側で(浅く)切断した尾に比べてより早く再生し、結果として、どちらの尾も同じタイミングで元のサイズに回復することが知られています。しかし、ドミナントネガティブ型のTead4を過剰発現すると、この尾の再生における位置特異的な成長速度の違いが見られなくなりました。これらの結果はHippo経路の転写因子であるYap1やTead4は脊椎動物の付加再生そのものに必要なだけでなく、付属器官の再生におけるサイズ制御にも必要であることを示唆しています。これらの発見は、再生医療において正常なサイズをもった3次元的な器官を作り出すことにも寄与するだろうと考えています。
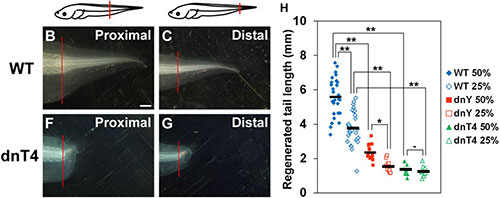
ツメガエルオタマジャクシの尾を深さ50% (proximal)と25% (distal)でそれぞれ切断し、ヒートショックをかけてTead4の作用を阻害すると、どちらの場合も尾の再生は阻害される(左図)。ここでは示していないが、このとき細胞増殖は阻害されアポトーシスが増加するものの再生自体は起こる(神経や筋肉の再生が観察される)。切断7日後に尾の再生した部分の長さを計測すると、野生型では深く切断された方が早く再生するが、Tead4を阻害すると切断部位による再生速度の差が見られなくなることが分かる(右図)。
Figure 5より改変。 (Elsevier Inc.)
ニワトリ前肢の前側でみられる発生過程の変化が、前肢の指の数が少ないという鳥類の特徴をもたらしている
Nomura, N. Yokoyama, H. and Tamura, K. Altered developmental events in the anterior region of the chick forelimb give rise to avian-specific digit loss. Developmental Dynamics. 2014, 243, 741–752. doi: 10.1002/dvdy.24117, PubMed
鳥類の前肢(翼)には指が3本しかありません。指が3本だけ形成される、というのは鳥類の肢に固有の特徴の1つであり、また、共通祖先の恐竜から進化的に受け継がれた特徴でもあります。ニワトリ胚を用いた指形成の研究はこれまで数多くなされていますが、前肢に3本の指が形成されるメカニズムについてはまだよく分かっていません。今回、私たちは、ニワトリ胚の前肢と後肢のそれぞれにおいて予定運命図を作成し、発生初期の肢芽のどの領域が指の形成に寄与するのかを同定しました。その結果、前肢芽の指形成領域は、後肢芽と比べて狭くなっていることが分かりました。このとき、前肢芽では後肢芽に比べて指形成領域の前側境界(親指をつくる領域と手首をつくる領域の境界)の相対的な位置がより後ろ側にあることが、前肢芽の指形成領域の幅が狭くなる原因と考えられました(後側境界の位置はほぼ同じでした)。これは、肢芽前側のこの領域ではたらく何らかの発生メカニズムが、指形成領域の縮小とその後の指の数の減少をもたらしていることを示唆しています。私たちはまた、前肢芽では肢芽前側の細胞死領域(ANZ)の出現する時期が早いこと、肢芽の伸長に必須の肥厚上皮である外胚葉性頂堤(AER)の前端が後ろ側に退縮すること、を明らかにしました。前肢芽の前側でみられるこれらの発生過程の変化が肢芽の予定運命に変化をもたらし、その結果、鳥類を特徴づける前肢の指の数の減少を引き起こしている、と考えられます。
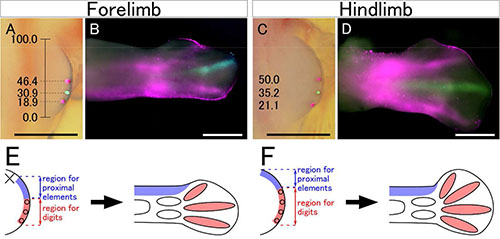
発生初期の前肢芽(図A)と後肢芽(図C)を蛍光色素で標識し、それぞれの肢芽の後端を0、前端を100としたときの相対的な位置を記録した後、発生後期における標識細胞の分布を調べた(図B,D)。その結果、前肢芽のもっとも前側には肢の構造の形成に参加しない領域(図E×印)が存在し、そのような領域が存在しない後肢芽に比べて肢の基部構造に寄与する領域(図E,F青)がより後ろ側まで分布していること、そのため前肢芽では後肢芽に比べて指形成領域(図E,F赤)の前側の境界がより後ろ側に位置していることが示された。一方、前肢芽と後肢芽の指形成領域の後ろ側の境界はほぼ同じ相対位置にあるため、結果として前肢芽では指形成領域の範囲が後肢芽よりも狭くなっている。
Figure 1およびFigure 2より改変。 (John Wiley & Sons, Inc.)
Hipppoシグナル経路の転写調節因子であるYap1はアフリカツメガエル肢芽再生に必要である
Hayashi, S. Tamura, K. and Yokoyama, H. Yap1, transcription regulator in the Hippo signaling pathway, is required for Xenopus limb bud regeneration. Developmental Biology. 2014, 388, 57-67. doi: 10.1016/j.ydbio.2014.01.018, PubMed
Hippoシグナル経路は、昆虫から哺乳類まで広く保存された細胞内シグナル伝達経路で、細胞増殖やアポトーシス、組織の恒常性など、様々な過程で重要な役割を果たしています。Hippoシグナルは再生においても重要であることが、扁形動物のからだやコオロギの脚の挿入再生(intercalary regeneration)の研究で知られています。しかし、脊椎動物の付加再生(epimorphic regeneration)におけるその役割はまだよく分かっていません。そこで私たちは、これらの左右相称動物の再生に共通する原理を同定するため、無尾両生類アフリカツメガエルの肢芽の再生におけるHippoシグナルの役割について調べました。その結果、Hippoシグナルの重要な下流エフェクターである転写因子Yap1が、肢芽再生の過程において活性化することが分かりました。そこで次に、肢芽再生におけるYap1の機能を解析するために、私たちはヒートショック処理によりドミナントネガティブ型のYapが発現するトランスジェニックツメガエルを作製しました。このツメガエルのオタマジャクシにヒートショック処理をしてドミナントネガティブ型Yapを発現させ、肢芽再生におけるYapの機能を阻害したところ、細胞増殖の減少、異所的なアポトーシスの誘導、hoxa13、hoxa11、shhなどの四肢パターン形成遺伝子の発現部位の異常が観察されました。また、同様にドミナントネガティブ型Yapを一過的に発現させたオタマジャクシには、肢芽の再生不全や挿入再生能力の低下が見られました。これらの結果は、Yap1がツメガエルの再生能力の制御に重要な役割を果たしていることを示すとともに、Hippoシグナルが脊椎動物と無脊椎動物のどちらにおいても同様に再生に関わっていることを示唆しています。今回の発見は、系統を超えた普遍的な再生原理の分子基盤となるものであり、また、新たな再生医療の発展へと繋がることも期待されます。
ツメガエルオタマジャクシの肢芽を切断し、切断時と切断3日後にヒートショックをかける(図D)と、野生型のオタマジャクシの後肢芽は後肢が完全に再生する(図F,G)のに対して、ヒートショックにより一過的にドミナントネガティブ型Yapを発現するトランスジェニックツメガエルのオタマジャクシの後肢芽は、貧弱な再生肢を形成する(図K,L)。切断していない後肢芽は野生型(図I)、トランスジェニック(図M)ともに発生して正常な後肢を形成する。Yapの強制発現は共発現するGFPによってモニターしている(図F,J)
Figure 3より改変。 (Elsevier Inc.)
ゼブラフィッシュの発生における胸ビレの伸長メカニズム
Yano, T., Abe, G., Yokoyama, H., Kawakami, K., and Tamura, K. Mechanism of Pectoral Fin Outgrowth in Zebrafish Development. Development. 2012, 139, 2916-2925. doi: 10.1242/dev.075572, PubMed, NODEにおける紹介
ヒレと四肢は、脊椎動物の有対付属肢であり相同器官と考えられますが、それらの発生過程でみられる形態には明らかな違いが存在します。そのなかでも大きな違いがみられる構造の一つに、有対付属肢の発生に重要な役割をもつと考えられている外胚葉性の上皮構造があります。ヒレと四肢の原基には、どちらにも先端部に外胚葉性頂堤(AER)と呼ばれる肥厚構造が現れますが、ヒレでは、発生の途中でそれがapical fold (AF)と呼ばれる、AERとはまったく異なる、長く伸びた扁平な構造へと移行するのです。四肢の発生におけるAERの役割はこれまでの多くの研究で明らかになってきましたが、ヒレの発生におけるAFの役割についてはほとんど知られていません。そこで、私たちは、ゼブラフィッシュの胸ビレにおいてAFが形態形成に及ぼす影響について調べました。受精後約36時間で起こるAERからAFへの移行(AER-AF transition)の後、AFはヒレ原基(鰭芽)周縁部の血管より外側の構造として見分けることができました。またAFは、基部AF(pAF)と先端部AF(dAF)の2つの領域に分けられることも分かりました。AFを切除すると、その再生のためにまずAERが再形成され、その後で再びAFへの移行が起こるのですが、興味深いことに、AFを繰り返し切除するとヒレ間充織の過剰な伸長がみられました。このことは、(切除により再形成されたAERから)AERシグナルがより長い期間作用することによって、内骨格を作るヒレ間充織が過剰に伸長したことを示唆しています。一方、先端部AFを切除すると基部AFの伸長に影響がでることから、先端部AFからのシグナルは基部AFに作用していると考えられます。私たちはまた、AF上皮の伸長が、細胞の増殖ではなく形態的変化によって引き起こされることを見出しました。これらの結果は、AER-AF transitionのタイミングによってヒレと四肢に違いが現れること、AERを維持するメカニズムの獲得が四肢発生過程の進化において重要であったこと、を示唆しています。
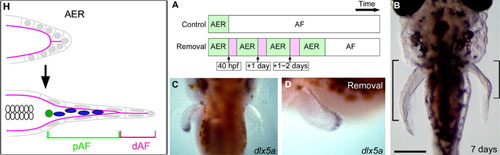
左図:鰭芽先端部の上皮に形成されたAER(左図上)は、受精後36時間頃からAF(左図下)へと移行する。AFは、内骨格を形成する間充織(左図下の白丸)を取り囲むように存在する血管(緑丸)よりも更に先端部側に形成され、内部に間充織細胞(青丸)をもつ基部AF(pAF)と、外胚葉性上皮のみで構成される先端部AF(dAF)に分かれる。右図:AERを繰り返し3回切除し、再生してくるAERによって内骨格を形成する間充織が正常な胚よりも長い間AERの影響下に置かれるようにする(右図A)と、内骨格を形成する間充織の過剰な伸長が起こる(右図B)。AERと初期AFで発現するdlx5aは、3回目の切除後、切除していない右の鰭芽では既に発現していないが、切除した左の鰭芽の再生したAERには発現している(右図C,D)。
Figure 1およびFigure 5より改変。 (The Company of Biologists)
鳥類の後肢軛脚部において軟骨形成に先立って起こる異時的(ヘテロクロニック)なHox遺伝子の発現低下
Kamiyama, N., Seki, R., Yokoyama, H., and Tamura, K. Heterochronically early decline of Hox expression prior to cartilage formation in the avian hindlimb zeugopod. Development Growth and Differentiation. 2012, 54, 619–632. doi: 10.1111/j.1440-169X.2012.01359.x, PubMed
四足動物の後肢軛脚(下腿部)の骨である腓骨は、動物種によって様々な形態をしています。下腿部のもう一つの骨である脛骨とほぼ同じ長さの腓骨を持つ種もいれば、脛骨とは全く異なるサイズの腓骨を持つ種もいるのです。たとえば鳥類の後肢では、腓骨は脛骨と比べて極端に短く、細くなっています。腓骨の基本的な形態は発生過程で作られますが、骨のもととなる軟骨原基が形成されるのは、Hox遺伝子の発現の組合わせ(Hoxコード)によって定められた特定の領域であることが知られています。では、どのようにして、同じ組合わせのHoxコードによって定められた領域に、腓骨のように種によって異なる形態が生じるのでしょうか。それを調べるため、私たちは、腓骨形成領域を定めるHoxd11とHoxd12の発現の時間的および空間的なパターンを、ニワトリ胚、マウス胚、ヤモリ胚の肢芽において調べ、それらを軟骨前駆細胞による間充織凝集部位(後に軟骨を形成する部位)と比較しました。その結果、ニワトリ胚の後肢ではHoxd11とHoxd12の発現が早期に減少し、軟骨が形成される前までに予定軛脚領域から消失することが分かりました。他の種ではこれらの遺伝子発現が軟骨形成開始後まで続いていたことからも、この異時的(ヘテロクロニック)なHox遺伝子の発現の低下は、鳥類後肢の腓骨がもつ特徴的な形質と非常によく相関しているものと考えられます。ニワトリ胚の前肢ではこのような発現低下はみられないので、これは(種の違いではなく)形態的な形質と関連しているようです。今回の結果は、Hoxコードの時間的変化が、これらの種間の相同構造における形態の多様性を作り出していることを示唆しています。
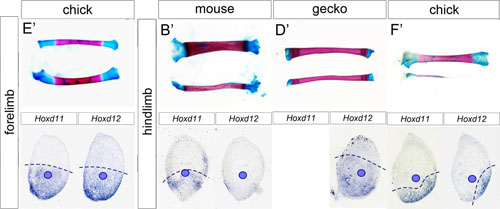
上段の図は左から、ニワトリ前肢の橈骨(上)尺骨(下)、マウス、ヤモリ、ニワトリ各後肢の脛骨(上)腓骨(下)。ニワトリ後肢を除き、軛脚の前側の骨(橈骨/脛骨)と後ろ側の骨(尺骨/腓骨)の長さはほぼ等しい。ただしマウス後肢の腓骨は脛骨よりも細い。ニワトリ後肢の腓骨は脛骨に比べて極端に短く、細い。下段には、軟骨形成後の各肢芽の横断面におけるHoxd11とHoxd12の発現と、尺骨/腓骨形成部位(青丸)を示す。腓骨が極端に細く短いニワトリ後肢では、腓骨形成部位におけるこれらのHox遺伝子の発現はこの時期までに消失する。(腓骨が細いマウス後肢においても、Hoxd12の発現はこの時期までに低下する。)
Figure 1およびFigure 8より改変。 (JSDB)
ヒレと四肢の違いをつくるもの
Yano, T. and Tamura, K. The making of differences between fins and limbs. Journal of Anatomy. 2013, 222, 100–113. doi: 10.1111/j.1469-7580.2012.01491.x, PubMed
“Evo-Devo(進化発生生物学)”は、発生生物学をベースに、器官の形態や機能が進化する過程を研究する学際的な研究分野です。そのEvo-Devo分野において非常に興味深いテーマの一つに、魚のヒレがどのように四足動物の肢に進化したのか、があります。これまでに、遺伝学、数理生物学、古生物学を含む多くの研究分野の研究者によって、ヒレと四肢が相同器官であることが示されてきました。そして今、これらのデータをまとめ、ヒレから四肢への進化のメカニズムについて合理的な構図を描くのが、発生生物学の仕事です。本研究では、ヒレや四肢、またその中間形態である四肢様ヒレ(limb-like fin)の発生に関わるメカニズムを研究するさまざまな分野の最近の重要な発生学研究をもとに、ヒレから四肢への変移について考察しました。その中で私たちは、ヒレと四肢の類似性と相違あるいはヒレから四肢への進化を、発生過程の側面から説明するため、「AF(apical fold)の抑制モード」という概念を提唱しています。四肢の発生では、肢芽先端上皮のAERが肢芽の伸長に必須であることが知られていますが、ヒレの発生では、始めに形成されたAERが発生の途中でAFと呼ばれる構造に変化します。私たちの仮説は、この形成されたAFによって、四肢の内骨格パターンの発生メカニズムは ──たとえ魚のヒレがそのメカニズムを潜在的に持っていたとしても── 抑制・中断されるというものです。このモデルはすべての顎口類の付属肢に適用することができます。
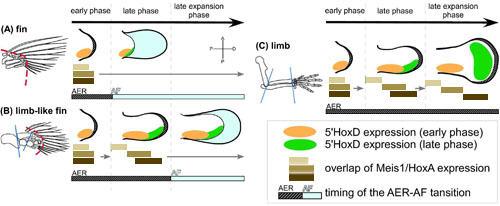
図Cに示すように、四肢では、5'HoxD遺伝子の後期エンハンサー活性化による発現部位の拡大(緑色)や、Meis/Hoxa11/Hoxa13遺伝子の発現領域の分離(薄茶、茶、濃茶のバー)によって、内骨格の3つのドメイン(柱脚・軛脚・自脚)が形成される。しかし、ヒレでは、発生の途中でAF(水色)が形成されて内骨格形成が抑制されるために、これらの遺伝子発現の変化が起こらず、内骨格パターンは貧弱になる(A)。一方、四肢様ヒレでは、AFの形成が遅いために不十分ながらもこれらの遺伝子発現の変化が起こるため、指は形成されないものの、3つのドメインの分離が起こる(B)。
Figure 5より改変。(Wiley)
アフリカツメガエル四肢再生におけるWnt/β-カテニンシグナル伝達に対する要求性は幼生と成体で異なる
Yokoyama, H., Maruoka, T., Ochi, H., Aruga, A., Ohgo, S., Ogino, H. and Tamura, K. Different requirement for Wnt/β-catenin signaling in limb regeneration of larval and adult Xenopus. PLoS ONE. 2011, 6, e21721. doi: 10.1371/journal.pone.0021721, PubMed
両生類の四肢再生において、再生芽が形成される初期過程は再生の成功のために非常に重要であり、成体ではこの過程に神経の存在が必要であることが知られています。アフリカツメガエルでは、幼生期に発生過程にある肢芽は完成な再生が可能であり、変態後の仔ガエルの発生を終えた四肢は神経依存的な過程を経て釘状の構造(スパイク)を再生します。ツメガエルの幼生のWnt/β-カテニンシグナル伝達が阻害されると四肢再生の開始が妨げられますが、仔ガエルの四肢再生におけるこの伝達経路の必要性はわかっていませんでした。そこで私たちは、ヒートショック処理によりWntアンタゴニストのDkk1が誘導されるhsDkk1トランスジェニックツメガエルを用いて、仔ガエル前肢の再生過程でWnt/β-カテニンシグナル伝達を阻害しましたが、四肢再生の阻害は起こりませんでした。ところが、仔ガエルの四肢の神経供給の一部を取り除くと、hsDkk1を発現させた仔ガエルの四肢再生が阻害されました。また、神経を完全に取り除くと仔ガエルの四肢再生は失敗しますが、これはGSK-3阻害剤を用いてWnt/β-カテニンシグナル伝達を活性化することで防ぐことができました。ここで示された幼生と仔ガエルのWnt/β-カテニンシグナル伝達に対する要求性の違いは、再生時の四肢領域での神経投射の有無に起因すると考えられます。またこれらの観察は、神経由来のシグナルとWnt/β-カテニンシグナル伝達は四肢再生の初期過程において重複した役割(冗長性)をもつことを示唆しています。今回の研究によって初めて、発生過程の肢芽(幼生)とすでに発生を終えた四肢(仔ガエル)では、神経由来のシグナルとWnt/β-カテニンシグナル伝達に関して、四肢再生の開始のメカニズムが異なることが示されました。
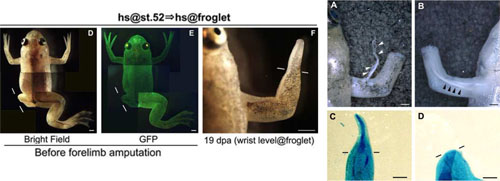
同一個体において幼生期と仔ガエル期にhsDkk1を発現させた四肢を切断すると、幼生期に切断した左後肢は再生できない(左図左)が、仔ガエル期に切断した右前肢にはスパイクが再生する(左図右)。左図中央は仔ガエル期にヒートショック処理をすることでhsDkk1-GFP融合タンパク質の発現が誘導されることを示している。hsDkk1を発現させた仔ガエルの四肢に投射する神経の一部を取り除いて再生させると(右図上段)、一部の個体ではスパイクが再生した(右図下段左)が、ほとんどの個体は再生が阻害された(右図下段右)。
Figure 3およびFigure 6より改変。(PLoS)
アフリカツメガエルにおいて瘢痕を伴わない皮膚の創傷治癒が起こるときのPrx1の発現とその付加再生との類似性
Yokoyama, H.*, Maruoka, T.*, Aruga, A., Amano, T., Ohgo, S., Shiroishi, T. and Tamura, K. Prx-1 expression in Xenopus laevis scarless skin-wound healing and its resemblance to epimorphic regeneration. Journal of Investigative Dermatology. 2011, 131, 2477-2485. doi: 10.1038/jid.2011.223, PubMed
*Contributed equally to this study
瘢痕を残さずに傷を治すことに対する医学的ニーズは高いにもかかわらず、それを達成するために必要な分子要因はよくわかっていません。哺乳類の成体では皮膚の創傷治癒の過程で瘢痕が形成される場合が多いですが、両生類の中には、たとえそれが四肢の切断であっても、損傷した体の一部を瘢痕を残さずに再生できるものがいます。そこで私たちは、再生できる四足動物で起こる完全な創傷治癒のメカニズムを明らかにするため、実験的に皮膚を除去したアフリカツメガエルの幼若個体(froglet、仔ガエル)における創傷治癒過程を調べました。その結果、アフリカツメガエルの仔ガエルに作った皮膚の創傷は、瘢痕を形成せずに完全に治癒することを見出しました。四肢や胴体部に作った皮膚の創傷や、再生過程にある四肢では、ホメオボックス遺伝子prx1を発現している単核の細胞が、傷口に新しく形成された上皮の下に集積していました。また、マウスprx1の四肢特異的エンハンサーに対するレポーターを発現するトランスジェニックガエルの仔ガエルでは、創傷治癒過程の皮膚と再生過程の四肢のどちらでもレポーター活性がみられました。一方で、マウス成体の皮膚の創傷治癒過程ではそれに相当するレポーター活性はみられませんでした。これらの結果は、瘢痕を伴わない皮膚の創傷治癒にはprx1の四肢特異的エンハンサーの活性化が必要であること、またこのエンハンサーを活性化する能力が四肢再生などの付加再生にまず必要となる能力であることを示唆しています。このprx1エンハンサー活性の誘導は、哺乳類に対して医学的目的で瘢痕を残さず創傷治癒させようする際に、瘢痕形成のない創傷治癒の有効なマーカーとして利用できるものと期待されます。
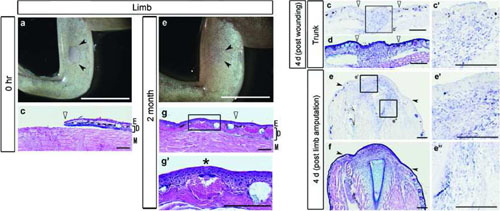
アフリカツメガエル仔ガエルの四肢の皮膚を除去して形成された創傷(右図左列)は、2か月後には瘢痕を残さず完全に治癒する(右図右列)。胴体部の皮膚除去後4日目の創傷部位(左図上段)あるいは四肢を切断後4日目の再生芽(左図中下段)では、どちらも傷口を覆う上皮直下の細胞にprx1を発現している。
Figure 1およびFigure 3より改変。 (npg)
胴部側板における肢/わき腹の部域化に対する沿軸中胚葉の役割
Noro, M., Yuguchi, H., Sato, T., Tsuihiji, T., Yonei-Tamura, S., Yokoyama, H., Wakamatsu, Y. and Tamura, K. Role of paraxial mesoderm in limb/flank regionalization of the trunk lateral plate. Developmental Dynamics. 2011, 240(7), 1639-1649. doi: 10.1002/dvdy.22666, PubMed
四足動物のからだにおける肢の大きさ、すなわち胴体部分に対する肢の幅の占める割合を決定する発生メカニズムを明らかにするため、私たちはニワトリ胚において肢とわき腹の指定に対する沿軸中胚葉の役割を調べました。その結果、私たちは肢領域に隣接する沿軸中胚葉が肢芽の前後軸と基部先端部軸に沿った大きさに影響を与えることを発見しました。また、私たちはわき腹に隣接する沿軸中胚葉が、肢芽の膨出とその後の伸長に対して抑制的に作用すること、側板中胚葉のわき腹特異的なアポトーシスを促進することも見出しました。これらの結果は、沿軸中胚葉からのシグナルがそれに応答能をもつ側板中胚葉に対して作用し、肢領域とわき腹領域を指定していることを示唆しています。
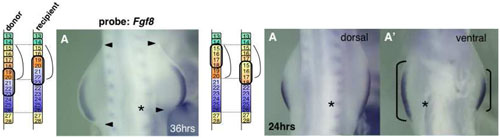
わき腹レベルの未分節中胚葉(PSM、体節形成前の沿軸中胚葉)を前肢レベルのPSMと交換移植すると、形成される前肢の大きさは交換移植していない左側の肢芽と比べ、小さくなる(左図、矢尻は肢芽の前・後端を示す)。一方、前肢レベルのPSMをわき腹レベルのPSMと交換移植すると、形成される肢芽は正常なものより大きくなる(右図、角括弧は肢芽の大きさを示す)。各模式図は交換移植した体節レベルを、各アスタリスクは移植部位を示す。
Figure 4およびFigure 5より改変。 (Wiley-Liss, Inc.)
鳥類の翼の指が第1、2、3指であることを示す発生学的な証拠
Tamura, K.*, Nomura, N.*, Seki, R., Yonei-Tamura, S. and Yokoyama, H. Embryological evidence identifies wing digits in birds as digits 1, 2, and 3. Science. 2011, 331, 753-757. doi: 10.1126/science.1198229, PubMed, プレスリリース
*Contributed equally to this study
鳥類の前肢(翼)にある3本の指が、四足動物の基本型である5本指のどの指に相当するのかについては長い論争がありました。というのは、古生物学的な証拠は第1、2、3指(母指、示指、中指)であること、発生学的な証拠は第2、3、4指(示指、中指、環指)であることをそれぞれ支持していたためです。今回、私たちは移植実験と細胞標識実験を用いて、ニワトリ前肢の最も後側の指(最後指)は、ニワトリ後肢の第4指とは異なる指であることを示しました。ニワトリ後肢の第4指をつくる前駆細胞は、発生初期から指の番号が指定される時期までずっと、肢芽のZPAとよばれる領域に留まっています。しかし、ニワトリ前肢の最後指をつくる前駆細胞は、発生初期には後肢第4指と同じくZPA内にあるものの、指の番号が指定される時期までに、ZPAの外の第3指指定領域に移動していたのです。今回の私たちの研究は、この鳥類に特異的なシフト(前駆細胞の移動)が、「指の原基」と「指のパターンをつくる分子メカニズム」の乖離を引き起こして、その結果、2、3、4番目の指の原基に第1、2、3指のアイデンティティーを付与していることを示唆しています。
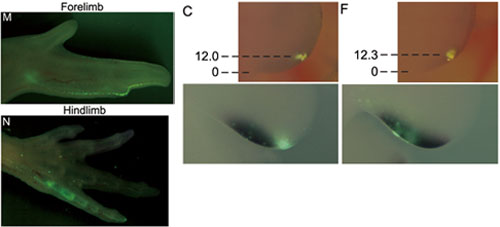
指の番号が指定される時期である発生段階22において、前肢(forelimb)と後肢(hindlimb)のZPA内を蛍光色素で標識すると、蛍光色素は前肢では指に分布せず、後肢では第4指に分布する(左図)。発生初期である発生段階20にZPA内で標識された細胞集団(右図上段)は、18時間後(発生段階22)になると前肢ではZPAの外に存在するが(右図下段左)、後肢ではZPA内にとどまっている(右図下段右)。
Figure 2およびFigure 3より改変。 (AAAS)
手板形成における肢芽の形態変化
Sato, K.*, Seki, R.*, Noro, M., Yokoyama, H. and Tamura, K. Morphogenetic change of the limb bud in the hand plate formation. Journal of Experimental Zoology Part B: Molecular and Developmental Evolution. 2010, 314B, 539-551. doi: 10.1002/jez.b.21359, PubMed
*Contributed equally to this study
脊椎動物の手板(掌と指の原基)は扁平な櫂状の形態、すなわち、親指から小指にかけての軸である前後軸方向に幅広く、手のひらから甲にかけての軸である背腹軸方向に薄いという形態をもっています。手板のこのような3次元構造がどのように形成されるのか、私たちは、発生段階23~27のニワトリ胚と産卵後11~13日のヤモリ胚の肢芽先端部の形態変化を観察しました。その結果、ニワトリ胚の肢芽先端部では、後ろ側の細胞集団の方が前側の細胞集団に比べてより前後に広がる傾向にあることが分かりました。これらの2つの細胞集団において基部先端部軸方向の広がりには有意な差がなかったことも考え合わせて、私たちは、肢芽の後ろ側の細胞集団の方がより肢芽形態の前後軸方向への拡大、すなわち、手板形成における肢芽の広がりに寄与していると考えています。私たちはまた、発生段階25のニワトリ胚肢芽において、背腹軸方向よりも前後軸方向に分裂する細胞の方が多いことを観察しました。この細胞分裂方向の偏りも肢芽形態の前後軸方向への拡大に寄与しているものと考えられます。
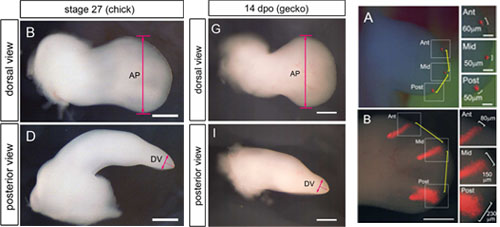
ニワトリ(chick)胚、ヤモリ(gecko)胚ともに、手板は肢芽のほかの領域よりも前後(AP)方向に幅広で背腹(DV)方向に薄い(左図)。発生段階23で同じ大きさの細胞集団をラベルし(右図上段)、48時間後に観察すると後ろ側の細胞集団ほどより前後方向に広がって分布していることが分かる(右図下段)。
Figure 1およびFigure 3より改変。 (Wiley-Liss, Inc.)
羊膜類の四肢において最前指形成に先立って起こる遺伝子発現の前方へのシフト
Uejima, A., Amano, T., Nomura, N., Noro, M., Yasue, T., Shiroishi, T., Ohta, K., Yokoyama, H. and Tamura, K. Anterior shift in gene expression precedes anteriormost digit formation in amniote limbs. Development Growth and Differentiation. 2010, 52, 223-234. doi: 10.1111/j.1440-169X.2009.01161.x, PubMed
四足動物の最も前側の指(最前指)には「小さい(短い)」「指骨の数が少ない」という共通の特徴があります。今回の私たちの研究では、発生中の肢芽が自脚部(指骨を含む領域)を形成している時期に肢芽の前側に特異的あるいは顕著に発現している3つの遺伝子、Mkp3、Sef、Tsukushi (TSK)に着目しました。これらの遺伝子の発現を肢芽の発生過程を追って調べると、その発現ははじめから前側に限定されているのではなく、発現領域は肢芽先端部全域から前側へと自脚部の形成時期までに変化することが分かりました。この発現領域の前方へのシフトは、前側でこれらの遺伝子の発現が維持され、後ろ側では抑制されることと関係しています。Fibroblast growth factor(FGF)はMkp3、Sef、Tsukushi (TSK)の発現をそれぞれ負に制御することが知られていますが、FGFをニワトリ前肢の最前指である第2指の予定形成領域に添加すると、第2指の軟骨の過剰な伸長が観察されました。これは、前側領域でFGFシグナリングが低下することでこれらの前側遺伝子の発現が維持されること、その結果としてニワトリ前肢の第2指に最前指としての特徴があらわれることを示唆しています。羊膜類の他のグループに属するマウスとヤモリの肢芽では、TSKの発現パターンはニワトリ胚とは異なっていましたが、Mkp3とSefの発現はニワトリ胚と同様に前方へのシフトがみられました。これらの遺伝子の転写産物の前側での蓄積やFGF活性の適切な制御は、最前指の種特異的な形態を制御しているのかもしれません。
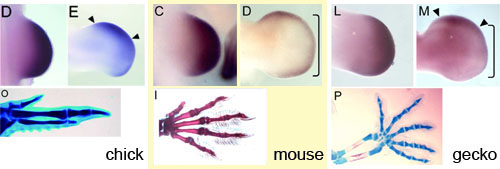
上段の写真に示したように、ニワトリ(chick)胚、マウス(mouse)胚、ヤモリ(gecko)胚のいずれの肢芽においてもsefの発現ははじめ肢芽の先端部全域で見られるが、自脚部の形成期には発現は肢芽前方へとシフトする。下段にはそれぞれの前肢の骨格パターンを示しているが、羊膜類の肢の最前指は小さく指骨の数も少ないことが分かる。写真はすべて上が前側、下が後ろ側。
Figure 1およびFigure 2より改変。 (JSDB)
アフリカツメガエルにおいてパターンのない肢が再生されるときのhoxa11とhoxa13の発現の解析
Ohgo, S., Itoh, A., Suzuki, M., Satoh, A., Yokoyama, H., and Tamura, K. Analysis of hoxa11 and hoxa13 expression during patternless limb regeneration in Xenopus. Developmental Biology. 2010, 338,148-157. doi: 10.1016/j.ydbio.2009.11.026, PubMed
四肢再生過程において無尾両生類の幼生と有尾両生類はパターン形成能をもつ再生芽細胞を生成し、失った四肢を3次元パターンも含めて再形成します。四肢再生能をもたない他の脊椎動物を再生させようと考えるとき、パターンを再生できる再生芽細胞とそれができない再生芽細胞との分子レベルの違いを明らかにすることが重要です。アフリカツメガエル成体の四肢切断後の再生芽細胞は、基部先端部軸のどのレベルで切断しても正常なパターンを持った四肢を再生できずに、パターンのないスパイクと呼ばれる構造を再生します。今回私たちは、アフリカツメガエル成体の再生芽には四肢の基部先端部軸パターンの形成に関わるhoxa11とhoxa13がともに再発現するものの、hoxa11とhoxa13の発現領域の分離が起こらないなど時間的空間的な発現パターンが異常であることを見出しました。私たちはまた、成体の再生芽には発生中の肢芽先端部の接着性に関わるEphA4が発現していないこと、hoxa11とhoxa13の不適切な発現を反映するかたちで位置依存的な細胞選別も起こらなくなることを示しました。hoxa11とhoxa13の発現量の定量的な解析からは、成体の再生芽のhoxa13の発現量が幼生の再生芽に比べて低いことが明らかになりました。さらに、軟骨分化の重要な調節因子であるsox9が幼生の再生芽に比べて成体の再生芽ではより早く発現を開始することも示しました。これらの結果は、再生芽細胞が適切なパターンを再生するためには、遺伝子発現制御が時間的空間的そして量的にも適切である必要があることを示唆します。
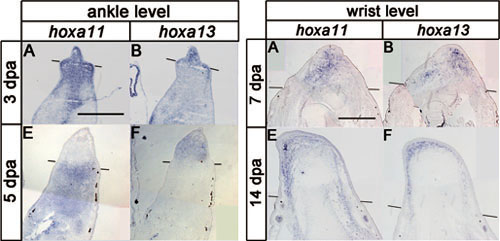
左図に示すアフリカツメガエル幼生の再生芽では、再生初期(3dpa)はhoxa11とhoxa13が再生芽全体でオーバーラップして発現しているが、再生が進む(5dpa)とhoxa11は基部にhoxa13は先端部へと発現が分離する。右図の成体の再生芽では、再生初期(7dpa)はもちろん再生が進んで(14dpa)も、hoxa11とhoxa13の発現の分離は起こらない。
Figure 2およびFigure 3より改変。 (Elsevier Inc.)
アフリカツメガエル成体の四肢再生におけるHedgehogシグナリング活性化の効果
Yakushiji, N., Suzuki, M., Satoh, A., Ide, H., and Tamura, K. Effects of activation of Hedgehog signaling on patterning, growth and differentiation in Xenopus froglet limb regeneration. Developmental Dynamics. 2009, 238, 1887-1896. doi: 10.1002/dvdy.22011, PubMed
有尾両生類やアフリカツメガエルの幼生の四肢再生過程では、「前後軸」「背腹軸」「基部先端部軸」の3つの軸に沿って失われた構造が再構築されます。一方、アフリカツメガエルの成体の四肢再生では、スパイクと呼ばれる皮膚と単純な軟骨からなる構造のみが形成され、指などのパターンを持った骨格は形成されません。これは、アフリカツメガエル成体の再生芽では指の骨格パターンの形成に必要とされる「前後軸」に沿ったパターン形成能力が不全であることを示唆しています。これまでの研究で、私たちは四肢の前後軸形成に重要なsonic hedgehog (shh)とその標的遺伝子が成体の再生芽に発現していないことをすでに示しています(Endo et al., 2000 DOI, Yakushiji et al., 2007 DOI)。
今回の研究では、私たちはhedgehogアゴニストを用いてhedgehogシグナリングを成体の再生芽で活性化すると、shhの標的遺伝子の発現が四肢再生芽の間充織に誘導されることを見出しました。さらに、このシグナリングの活性化によって再生芽細胞の増殖と軟骨形成が引き起こされること、その結果、再生体に複数の軟骨要素からなる構造が形成されることを明らかにしました(下図)。これらの結果は、アフリカツメガエル成体の再生芽で通常は不活性であるshhシグナリングを人為的に活性化することで、アフリカツメガエル成体の四肢再生能力を向上させることができることを示しています。
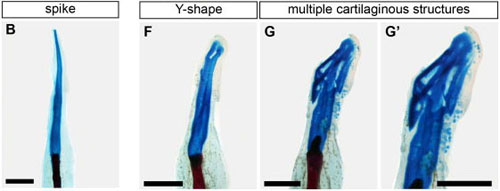
アフリカツメガエル成体(幼若個体)の四肢再生によって形成されるスパイクの軟骨は、分岐や分節を持たない(B)。しかし、四肢切断後の個体をHedgehogアゴニスト存在下で飼育して再生を行わせると、Y型に分岐した軟骨構造(F)や、複数の軟骨要素からなる構造(G, G')を形成する。
Figure 2より改変。 (Wiley-Liss, Inc.)
ソメワケササクレヤモリParoedura pictusの発生段階表
Noro, M., Uejima, A., Abe, G., Manabe, M., and Tamura, K. Normal developmental stages of the Madagascar ground gecko Paroedura pictus with special reference to limb morphogenesis. Developmental Dynamics. 2009, 238, 100-109. doi: 10.1002/dvdy.21828, PubMed
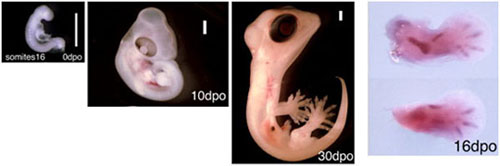
動物発生学の研究において、対象とする動物の発生段階表はとても有益な情報をもたらします。爬虫類有鱗目の発生段階表はすでにいくつかの種で作成されていますが、ヤモリ科のトカゲについてはこれまで報告はありませんでした。今回私たちは、ソメワケササクレヤモリParoedura pictusの発生段階表を作成しました。この発生段階表は産卵から孵化までの胚を孵卵日数と外部形態から27の発生段階に分けて表しています。ソメワケササクレヤモリの産卵から孵化までにかかる時間は60日ですが、産卵の時点で胚にはすでに8~16個の体節が見られ、その後の発生で体節は1日あたり5~6個ずつ付け加えられていきます。肢芽の膨らみは産卵後3日で観察されます。孵卵後2週間で予定自脚領域に手根骨/足根骨の軟骨形成が認められ、すべての指の軟骨は産卵後3週間までに形成されます。皮膚の色素は孵卵4週間で見られはじめ、皮膚の模様のパターンが明瞭になるには産卵後40日かかります。
ソメワケササクレヤモリは1年を通して交配でき、飼育下でいつでも卵を得ることができます。また、卵殻が軟らかい他の多くのトカゲと異なり硬い卵殻を持っているため、胚に対する顕微操作とその後の孵卵が可能です。さらに、アノールのゲノム情報を用いることで私たちはいくつかの遺伝子断片の単離に簡単に成功しています。これらのことから、ソメワケササクレヤモリは有羊膜類の発生を実験研究するためのモデル動物として大変有用であると私たちは考えています。
左から、孵卵後0日目、10日目、30日目のソメワケササクレヤモリ胚(スケールバー:1mm)。右の写真は16日胚の前肢芽(上)後肢芽(下)におけるAggrecan1遺伝子の発現。前肢芽の第2~5指、後肢芽の第3~5指でAggrecan1の発現を伴う軟骨凝集がみられる。
Figure 2およびFigure 5より改変。 (Wiley-Liss, Inc.)
タイムラプス解析によって心臓原基のCループ形成過程における領域ごとの非対称な形態変化を明らかにする
Kidokoro, H., Okabe, M., and Tamura, K. Time-lapse analysis reveals local asymmetrical changes in C-looping heart tube. Developmental Dynamics. 2008, 237, 3545-3556. doi: 10.1002/dvdy.21662, PubMed
心臓の発生は左右非対称な形態形成のモデルシステムとして古くから解析されており、また心臓の非対称なループ形成の過程には多くの主要な左右非対称形成遺伝子が関わっていることも示されています。私たちはニワトリの心臓原基のCループ形成過程を観察するためのタイムラプス観察システムを確立し、そのシステムを用いてCループ形成がいくつかの領域ごとの形態変化を含むとても複雑な過程であることを明らかにしました。その過程は「心臓原基前方部の腹側への屈曲を伴う前方部および後方部の右方捻転」と「後方部における左側のサイズ増大を伴う反時計回りの水平回転」に分けられます。さらに私たちは胚に実験操作を加えることでこれらの形態的な変化の特徴と前方部と後方部の相互関係についても明らかにし、左右遺伝子の標的の一つに後方部の左右非対称なサイズ増大があることを提唱しています。
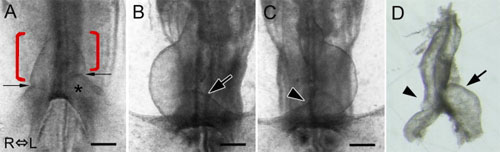
Cループ形成前のまっすぐな心臓原基にもすでに形態に左右差が見られる(A)。Cループ形成完了後の心臓原基では、後方部右側(Cの矢尻)にはみられない隆起が後方部左側(Bの矢印)に認められる。心臓原基を摘出して観察すると(D)、原基後方部の左側(矢印)は右側(矢尻)に比べてはるかに大きいことが分かる。(写真はすべて腹側から観察したもので、写真の左側が心臓原基の右側となる。)
Figure 2より改変。 (Wiley-Liss, Inc.)
顎口類胚において四肢・鰭の形成位置に多様性をもたらす帯状のコンピテンス
Yonei-Tamura, S.*, Abe, G.*, Tanaka, Y., Anno, H., Noro, M., Ide, H., Aono, H., Kuraishi, R., Osumi, N., Kuratani, S., and Tamura, K. Competent stripes for diverse positions of limbs/fins in gnathostome embryos. Evolution & Development. 2008, 10, 737-745. doi: 10.1111/j.1525-142X.2008.00288.x, PubMed
*Contributed equally to this study
すべての脊椎動物は固有の形態をもち、それぞれの生活様式や生息場所に適応しています。四肢や鰭は、大きさや形、形成位置の多様性が特に目立つ器官です。この多様な形態はそれを生み出す胚発生プログラムが多様であることを想像させますが、さまざまな胚の比較研究からは、四肢や鰭の形成には共通のメカニズムがはたらいていることが示唆されています。
今回、私たちは主要な顎口類のすべてのグループにおいて、背中の正中と体の左右の腹側部に付属肢形成のコンピテンス(応答能)を持つ連続した帯状の領域が存在することを示しました。また、私たちは軟骨魚類胚の鰭原基は他の顎口類のグループと同様に原基後端にsonic hedgehogを発現しており、前後軸形成のメカニズムも共有していることも示しました。これらの結果から私たちは、顎口類には祖先動物から受け継がれた共通の発生プログラムによって規定される連続した帯状の付属肢形成コンピテンスが存在するという説を唱えています。この概念に基づいて考えると、それぞれのグループの動物の四肢と鰭の多様な形成位置を説明することができます。
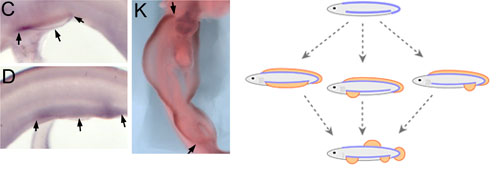
四足動物では肢芽先端部上皮(AER)と間充織で発現するmsx1遺伝子が、軟骨魚類のトラザメ胚とガンギエイ胚では対鰭の鰭原基だけでなくその間のわき腹領域にも連続して発現する(トラザメ胚: C, D; ガンギエイ胚: K)。右図の青線は、付属肢形成コンピテンスをもつ帯状の領域を示す。コンピテンスをもつ領域内で動物種に応じた位置に四肢・鰭が形成されると考えると、現在考えられている3タイプの原始顎口類(中段)と現生の顎口類(下段:典型例)のすべての付属肢形成位置を説明することができる。
Figure 2およびFigure 5より改変。 (Blackwell Publishing Inc.)
両生類四肢再生における四肢特異的ShhエンハンサーのDNAメチル化状態とShh発現との関係
Yakushiji, N., Suzuki, M., Satoh, A., Sagai, T., Shiroishi, T., Kobayashi, H., Sasaki, H., Ide, H., and Tamura, K. Correlation between Shh expression and DNA methylation status of the limb-specific Shh enhancer region during limb regeneration in amphibians. Developmental Biology. 2007, 312, 171-182. doi: 10.1016/j.ydbio.2007.09.022, PubMed
アフリカツメガエル成体の四肢は非常に限られた再生能しかもっておらず、四肢を切断してもパターンをもった指などの構造は形成されずに単純な軟骨のスパイク構造のみを再生します。今回私たちは四肢の前後軸パターンの形成に重要なsonic hedgehog (Shh)とその下流の遺伝子群がアフリカツメガエル成体の再生芽に発現しないことを示しました。さらに私たちは、完全な再生をする幼生期にはShh遺伝子の四肢特異的エンハンサーが低メチル化状態であるのに対し、成体では高メチル化状態であることを見出しました。アフリカツメガエルのShhプロモーター領域がほとんどメチル化されていないことを考え合わせると、これらの結果はアフリカツメガエル成体の再生不全がShhのエンハンサー領域のメチル化状態に相関していること、四肢再生過程においてパターン形成遺伝子が再び活性化するために標的特異的なエピジェネティック制御が関わっていることを示唆しています。再生できる(再生芽にShhを再発現できる)他の両生類ではこのエンハンサー領域のメチル化は低く抑えられていることから、低メチル化状態が四肢再生過程でShhの転写が起こるための基本条件だと考えられます。この論文で示したこれらの発見は、脊椎動物の器官再生におけるエピジェネティック制御とパターン形成の関係を初めて明らかにしたものです。
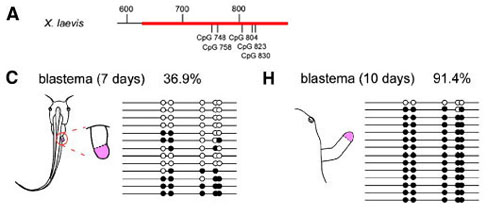
アフリカツメガエルの四肢特異的ShhエンハンサーMFCS1には5つのCpG(メチル化サイト)が存在する(A)。幼生と成体の再生芽細胞から単離したMFCS1クローンのCpGのメチル化状態を調べ、それぞれのクローンについてメチル化していたものを黒丸、していないものを白丸で示した(幼生: C, 成体: H)。36.9%のCpGがメチル化していた幼生に比べ、成体では91.4%と非常に高いメチル化状態にあることが分かる。
Figure 3より改変。 (Elsevier Inc.)
