梅津大輝 助教


-はじめに-
生き物のかたちは様々ですが、異なったかたちをつくるのにも共通の原理があります。最近の研究から、一見異なる形態形成過程にも共通の細胞の性質や決まった分子の特性が用いられていることが明らかになってきました。様々な形態形成の過程で繰り返し用いられる普遍的で重要な細胞や分子の挙動がどのような仕組みで構成されているのか、またどのような使い方によってかたちの違いを生み出すのかという疑問を、ショウジョウバエという小さな生き物を材料に、遺伝学的、分子生物学的に加え、力学的なアプローチも取り入れて解き明かしたいと考えています。

-最近の研究について-
生き物の体を作る細胞は、それ自身意思も知性も持ちませんが、集団として集まるといつの間にか秩序だった組織や器官を作ることができます。この離れわざを、細胞は誰の指図を受けることなく、お互いのやり取りだけに頼って成し遂げます。これはちょうど、鳥や魚の群れがあたかも知性を持った一つの個体かのように振る舞う様に似ています。群れを作る一つ一つの個体は、全体を見渡すことができるわけではなく、自分の近くの情報だけを頼りにどのように行動すべきかを決めています。それが、結果として、集団全体のまとまりのある「知性的」な動態につながるわけです。このような能力は、生物を生物たらしめ、あらゆる生命現象の根幹に位置するものと考えられます。
私たちは、生物のゲノムに刻まれた遺伝子情報の究極的な目的は、細胞同士のやり取りのルールを決めることにあると考えています。このような遺伝子機能の捉え方に基づいて、多細胞生物のゲノムに刻まれた個体の形作りを支配するアルゴリズム、すなわち、個々の細胞が従うべき”ローカルルール”を解き明かします。遺伝学、分子生物学、画像解析技術、そして数理アプローチを取り入れて様々な角度からこの問題の解明に迫ります。組織や器官の構築原理を明らかにすることで、再生医療分野などの医療応用に新たなアプローチをもたらすことも期待されます。
-メッセージ-
最新型のアイフォンをバラして中身を見るよりも、うん十年前のトランジスタラジオをバラして見る方が電波の受信の仕組みについてよっぽど理解が深まるでしょう。ショウジョウバエは我々人間の体と比べてはるかに小さく、単純ではありますが、生き物の体の形作りということに関しては、ヒトの臓器の形成や維持に必要な原理をすべて網羅するほど十分な複雑さを備えています。
その小さな体にローカルルールがたくさん詰まったショウジョウバエを材料に、細胞社会の構築と維持の原理を明らかにすることを目指します。特にライブイメージングに適している蛹の時期のイベントに注目して、生き物の中で起こる現象をライブでありのままを細胞レベルで詳しく観察し、遺伝子レベル、細胞レベル、組織レベルで現象の解明を目指します。
まずは、よく観察すること、そして、新しい何かを自分の頭で考えて導き出すことを学んでもらいます。そのアイデアを検証するための、様々なアプローチを一緒に考えます。時には遺伝学、時には生化学、時にはビッグデータ解析、時には数理モデルを用いるなど、必要に応じてあらゆるアプローチで解析を進め、確かな証拠を積み上げていくことを理想としています。

-これまでの研究-
○上皮組織における境界の維持
異なる機能を持つ細胞を選り分け、組織を区画化することは形態形成で最も重要な過程の一つです。例えば、脊椎動物の脳の発生ではいくつもの区画が生じることが知られています。組織の区画化は脊椎動物からショウジョウバエの発生にまで見られ、多細胞生物のボディプランの確立に共通の戦略として用いられています。ショウジョウバエの翅において細胞系譜を追跡することにより、翅は前部と後部の二つの区画に分かれ、細胞はその境界を跨ぐことができないことが示されました(Garcia-Bellido, et al., 1973, Nat. New Biol.)。このような区画はコンパートメントと呼ばれます。私たちは、細胞を選り分けるための物理的及び細胞生物学的なメカニズムの解明をめざし、ショウジョウバエの成虫原基及び腹部上皮に存在する前部/後部コンパートメント境界(A/P境界)をモデルに用いて研究を進めてきました。
この現象の力学的な側面に注目し、マイクロレーザー切除によって、組織内において細胞間結合にかかる張力を推定するという先進的な手法も取り入れ、境界上で細胞間張力が局所的に高まっていることを示しました。この局所的な張力の増加の意義を検証するために、構成論的なアプローチを取り入れました。理論物理学者との共同研究により、数理モデルを用いたシミュレーションを行った結果、局所的な張力の増加には、境界をまっすぐに維持する働きがあることが明らかになりました(Landsberg*, Farhadifar*, Ranft*, Umetsu*, et al., Curr. Biol., 2009)。さらに、長時間のライブイメージングにより、細胞一つ一つの動態を定量化し、局所的な張力がどのように細胞の挙動を制限し、境界維持につながるかを明らかにしました(Umetsu, et al., Curr. Biol., 2014)。
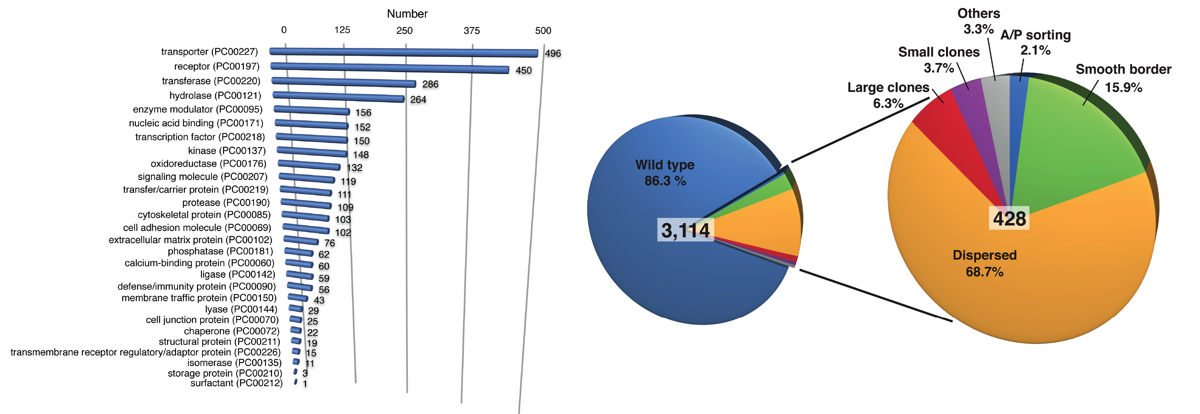
大規模な遺伝学的スクリーニングにより、脊椎動物においても境界形成に関わっているEph遺伝子を候補遺伝子として同定しました(Umetsu, et al. PLoS ONE, 2014)。

○組織リモデリング
私たちの体を作る細胞は常に入れ替わっており、不要になった細胞は除去されます。昆虫の変態はその極端な例で、蛹の時期になると、幼虫の体を作っていた細胞は一斉に取り除かれ、代わりに、成虫の体を作る細胞で完全に入れ替えてしまいます。この過程がどのような仕組みで制御されているのかを明らかにします。
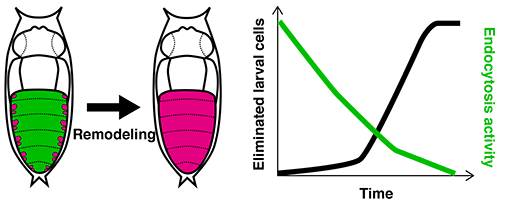
表皮組織のリモデリングの一部始終を生きたまま顕微鏡で観察し、時間が経つにつれて幼虫細胞の物質の取り込み活性(エンドサイトーシス)が徐々に弱まっていくことを発見しました。エンドサイトーシス活性を人為的に弱めると、細胞死のプログラムが活性化し、幼虫細胞の除去のスピードが速まります。これらのことから、幼虫細胞は、エンドサイトーシスを行うことによって除去されないように必死に抵抗しているのですが、その活性が弱まってしまうことによって一斉に細胞死に追い込まれてしまうということが分かりました(Hoshika et al., Development, 2020)。この研究成果は、変態において細胞の入れ替えのスピードを速める仕組みを明らかにした世界初の例で、がん細胞などの組織に不要な細胞の除去を促すような新規の医療技術の開発に発展することが期待されます。
大学院生修士課程の星加くん、孫さんがこの研究に取り組んでくれました。

○画像解析
上皮細胞の形態は様々な物理的な力の影響を受けて変形し、上皮組織全体の組織形成に寄与します。どのような力を使って組織形成を行なっているのかを知ることが本質の理解につながりますが、それには、一つ一つの細胞の形態や動態を定量的に解析することがとても重要です。そこで、私たちは画像解析技術の開発にも取り組んでいます。
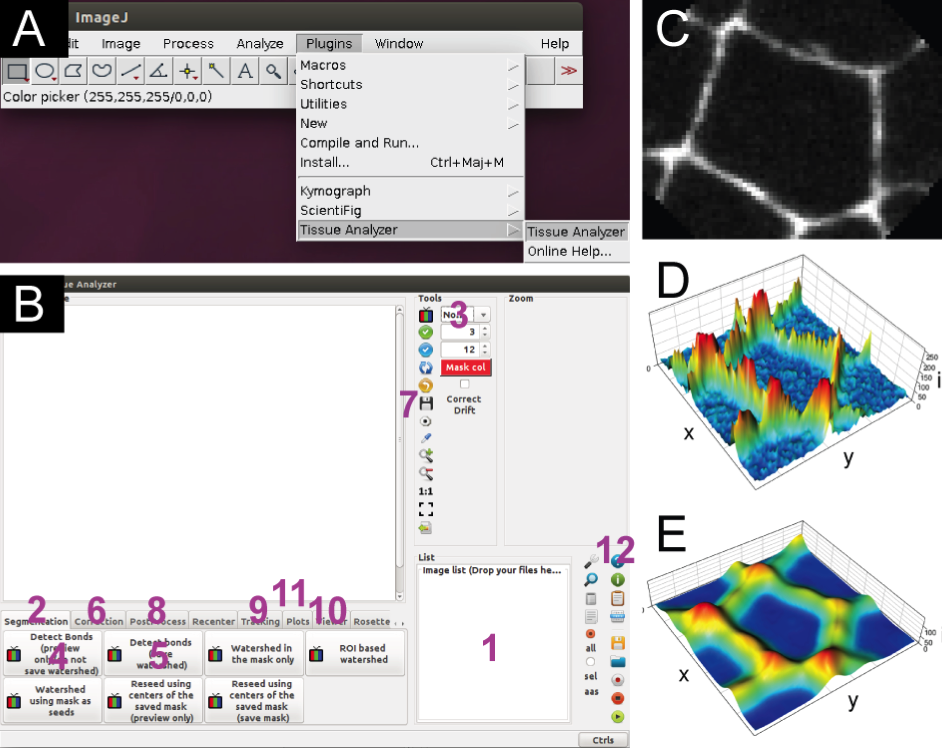
上皮組織を構成する細胞一つ一つの形態を数値化し定量的に解析するためのアプリケーションTissue Analyzerを共同で開発しました(https://grr.gred-clermont.fr/labmirouse/software/WebPA/)。現在、生命科学分野で最も広く利用される画像解析ソフトImageJのプラグインとして誰でも利用できます。
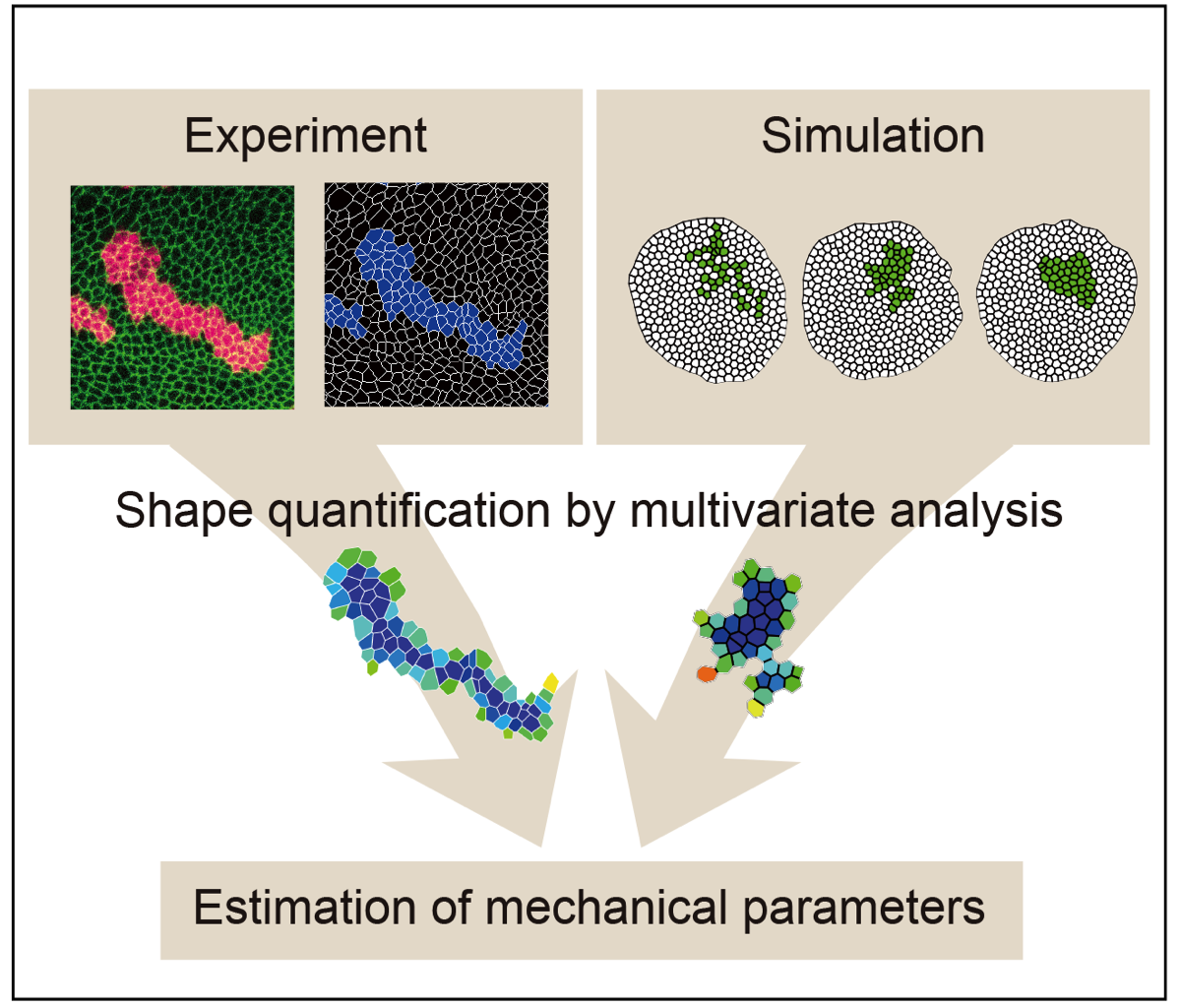
数理モデルによるシミュレーションと遺伝学的手法を組み合わせることで、不均一な細胞集団からなる組織の中で細胞集団間にどのような力が加わっているかを画像情報から推定するパイプラインを確立しました(Tsuboi*, Umetsu*#, et al., Front. Cell Dev. Biol., 2017)。

-経歴-
2016-現在 東北大学大学院 生命科学研究科 組織形成分野 助教
2014-2016 理化学研究所 発生・再生科学総合研究センター(2014年10月より多細胞システム形成研究センターに改称) 研究員
2012-2014 Technische Universität Dresden ポスドク
2007-2012 Max Planck Institute of Molecular Cell Biology and Genetics, Dresden ポスドク(EMBO fellow, 海外学振特別研究員)
2006-2007 東京大学 分子細胞生物学研究所 21COEプログラム 特任研究員
2002-2006 東京大学大学院 理学系研究科 生物化学専攻 博士課程 (2004-2006 学振特別研究員DC2)
2000-2002 東京大学大学院 理学系研究科 生物科学専攻 修士課程
1996-2000 埼玉大学 理学部 分子生物学科

-論文・出版物-
*: co-first author、#:corresponding author
-2020-
1)Hoshika, S., Sun, X., Kuranaga, E#., and Umetsu, D#.
Reduction of endocytic activity accelerates cell elimination during tissue remodeling of the Drosophila epidermal epithelium
Development, The Company of Biologists Ltd, 2020, in press
-2018-
2) Tsuboi, A., Ohsawa, S., Umetsu, D., Sando, Y., Kuranaga, E., Igaki T., and Fujimoto, K.
Competition for Space Is Controlled by Apoptosis-Induced Change of Local Epithelial Topology
Current Biology, Cell Press, 28: 2115-2128, 2018
-2017-
3) Tsuboi, A*., Umetsu, D*#., Kuranaga, E. and Fujimoto, K#
Inference of Cell Mechanics in Heterogeneous Epithelial Tissues Based on Multivariate Clone Shape Quantification.
Front. Cell Dev. Biol., frontiers 5:68, 2017
4) Umetsu, D. and Kuranaga, E.
Planar polarized contractile actomyosin networks in dynamic tissue morphogenesis
Current Opinion in Genetics & Development, Elsevier Ltd, 45:90-96, 2017 [Review]
-2015-
5) Rudolf, K., Umetsu, D., Aliee, M., Sui, L., Jülicher, F. and Dahmann, C.
A local difference in Hedgehog signal transduction increases mechanical cell bond tension and biases cell intercalations along the Drosophila anteroposterior compartment boundary.
Development, The Company of Biologists Ltd, 142: 3845-3858, 2015
6) Umetsu, D. and Dahmann, C.
Signals and mechanics shaping compartment boundaries in Drosophila
WIREs Developmental Biology, Wiley-Blackwell, 4(4):407-17, 2015 [Review]
-2014-
7) Umetsu, D., Dunst, S., and Dahmann, C.
An RNA interference screen for genes required to shape the anteroposterior compartment boundary in Drosophila identifies the Eph receptor.
PLOS ONE, PLOS, 9(12): e114340, 2014
8) Umetsu, D., Aigouy, B., Aliee, M, Sui, L., Eaton, S., Jülicher F., and Dahmann, C.
Local increases in mechanical tension shape compartment boundaries by biasing cell intercalations.
Current Biology, Cell Press, 24: 1798-1805, 2014
-2010-
9) Sugie, A., Umetsu, D., Yasugi, T., Fischbach, K.-F., and Tabata, T.
Recognition of pre- and postsynaptic neurons via nephrin/NEPH1
homologs is a basis for the formation of the Drosophila retinotopic map
Development, The Company of Biologists Ltd, 137; 3303-3313, 2010
10) Yasugi, T., Sugie, A., Umetsu, D., and Tabata, T.
Coordinated sequential action of EGFR and Notch signaling pathways
regulates proneural wave progression in the Drosophila optic lobe
Development, The Company of Biologists Ltd, 137; 3193-3203, 2010
11) Sawatsubashi S., Murata T., Lim J., Fujiki R., Ito S., Suzuki E., Tanabe M., Zhao Y., Kimura S., Fujiyama S., Ueda T., Umetsu D., Ito T., Takeyama KI., Kato S.
A histone chaperone, DEK, transcriptionally coactivates a nuclear receptor
Genes & Development, Cold Spring Harbor Press, 24: 159-170, 2010.
12) Umetsu, D. and Dahmann, C.
Compartment boundaries: Sorting cells with tension
Fly, Landes Biosciences, 4:3, 241-245, 2010
-2009-
13) Landsberg, K.*, Farhadifar, R.*, Ranft, J.*, Umetsu, D.*, Widmann, T., Bittig, T., Said, A., Jülicher, F. and Dahmann, C.
Increased cell bond tension governs cell sorting at the Drosophila anteroposterior compartment boundary
Current Biology, Cell Press, 19: 1-6, 2009.
-2008-
14) Yasugi, T.*, Umetsu, D.*, Murakami, S., Sato, M. and Tabata, T.
Drosophila optic lobe neuroblasts triggered by a wave of proneural gene expression that is negatively regulated by JAK/STAT.
Development, The Company of Biologists Ltd, 135: 1471-80, 2008.
-2007-
15) Murakami, S., Umetsu, D., Maeyama, Y., Sato, M., Yoshida, S. and Tabata, T.
Focal adhesion kinase controls morphogenesis of the Drosophila optic stalk.
Development, The Company of Biologists Ltd, 134: 1539-48, 2007.
-2006-
16) Umetsu, D., Murakami, S., Sato, M. and Tabata, T.
The highly ordered assembly of retinal axons and their synaptic partners is regulated by Hedgehog/Single-minded in the Drosophila visual system.
Development, The Company of Biologists Ltd, 133: 791-800, 2006.
17) Sato, M., Umetsu, D., Murakami, S., Yasugi, T. and Tabata, T.
DWnt4 regulates the dorsoventral specificity of retinal projections in the Drosophila melanogaster visual system.
Nature Neuroscience, Nature Publishing Group, 9: 67-75, 2006.
-2005-
18) Yoshida, S., Soustelle, L., Giangrande, A, Umetsu, D., Murakami, S., Yasugi, T., Awasaki, T., Ito, K., Sato, M. and Tabata, T.
DPP signaling controls development of the lamina glia required for retinal axon targeting in the visual system of Drosophila.
Development, The Company of Biologists Ltd, 132: 4587-4598, 2005.
