□出来事・更新情報
□研究内容
□publication list
□メンバー
□アルバム
□学生募集
□アクセス
□リンク

|
|
ダイオキシンの話
ダイオキシンはテレビや新聞で大きく報道されているように、強力な毒で、史上最強とうたわれています。ここでは、なぜその毒性が非常に少ない量でどんな生体メカニズムによって発揮されるのか、現在までに分かっていることをお話したいと思います。かなり分かってきていますが、肝心なところは今ひとつといったところです。 |
||||||||
| ダイオキシンがからだの中に入るといろいろな変化が起こります。極端な場合は死んでしまいますが、最も定量的な変化は、解毒酵素の増加です。ダイオキシンによって酵素が誘導されたといいます。酵素活性を測るとある程度ダイオキシンの量がわかります。解毒酵素といっても非常に多くの種類がありますが、ダイオキシンで誘導される一群の解毒酵素があって、メチルコランスレン誘導型酵素といわれています。なかでも、シトクロームP-450という解毒酵素の仲間のうちで、シトクロームP-450 1A1とシトクロームP-450 1A2という酵素が強く誘導されます。最近では、この二つの酵素は、それぞれCYP1A1とCYP1A2と簡単に呼ばれています。この二つのP-450に関して、膨大な酵素活性や誘導機構に関する研究がなされてきました。 | ||||||||
| その誘導のメカニズムは、 1. CYP1A1とCYP1A2の酵素量の増加は、mRNA量の増加によってもたらされるということになっています。つまりおもに遺伝子が 転写される活性が増加するということです。おもにと書きましたのは、mRNAの安定化も寄与していることが報告されているためで す。 2. 遺伝子の活性化は、受容体型転写因子Ahリセプター(AhR)が中心となって行われます。AhリセプターのAhは芳香族炭化水素を表すAryl hydrocarbonの略です。転写因子は転写に関係するタンパク質をそう呼び、DNAに結合することができます。 3. AhRは受容体としての活性もあり、多くの低分子有機化合物をリガンドとして結合します。ダイオキシンもその中の一つです。とびぬけて低い濃度で、AhRと結合します。先程書いたメチルコランスレンも代表的なリガンドです。 4. リガンドを結合したAhRはコンフォメーション変化を起こし、DNAに結合できるようになり、種々の遺伝子の転写調節領域に結合して転写量を増加します。 5. 転写量の増えた遺伝子として、非常に多彩な遺伝子が活性化されますが、その中にCYP1A1, CYP1A2があり、リガンドとして細胞に入った低分子有機化合物を酸化的に修飾し、その他の誘導される解毒酵素とともに働いて、いわゆる解毒反応がおき排出されます。 6. ダイオキシンは、誘導されるP450を始めとする解毒酵素では代謝することができないので、強い毒性が起きる原因と考えられています。 |
||||||||
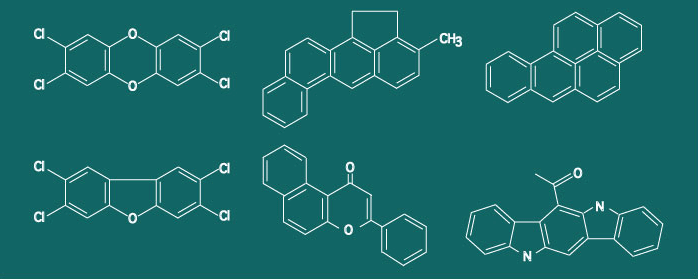
| AhRに結合するリガンドの種類と構造 AhRのリガンド特異性は述べましたように、それほど厳密ではなく多彩であります。図にAhRのリガンドとなる代表的なP4501A1の誘導物質の分子構造を示しました。 |
||||||||
 |
||||||||
| 上段左から2,3,7,8-Tetrachlorodibenzo-p-dioxin(TCDD),3-Methylcholanthrene(3MC), Benzo[a]pyrene(B[a]P) 下段左から2,3,7,8-Tetrachlorodibenzofuran(TCDF),b-Naphthoflavone(BNF), 6-Formylindolo[3,2-b]carbazole |
||||||||
| AhRのリガンドでCYP1A1やCYP1A2を強く誘導する化合物は、ヒトが作り出したものではメチルコランスレン、ベンツピレン、ベンズアントラセンなどの多環芳香族炭化水素、TCDD、TCDF、ポリ塩化ビフェニルなどのハロゲン化芳香族炭化水素、チアゾリウム化合物のYH439などがあります。ダイオキシンと呼んでいるものは、ハロゲン化されたジベンゾダイオキシンで、多くの異性体があります。そのなかで2,3,7,8-四塩化ダイオキシン(TCDD)は最も強くAhRに結合します。 | ||||||||
| 天然のリガンドとしては、キャベツやブロッコリーなどのアブラナ科の野菜には、比較的大量にインドール-3-カルビノール前躯体が含まれており、容易にインドール-3-カルビノールに変化し、さらに胃酸によってインドール-3-カルビノールは縮合しAhRの強いリガンドに変化することが知られています。また、トリプトファンの代謝産物にAhRの強いリガンドとなるものが見出されています。 | ||||||||
| 動物本来が持っている内在性のリガンドが存在するか否かは、いまのところよくわかっていません。明日にでも、見つかるかもしれませんし、実際そういったものはないのかもしれません。この問題も深いのですが、ここでは立ち入りません。 | ||||||||
| ベンツピレンやメチルコランスレンは薬物代謝酵素によって酸化されて、最終的な抱合体になる前の中間物質が、DNAと反応し、いわゆる遺伝子に突然変異を引き起こす発がん物質となります。ダイオキシン類は代謝されないので、発がんのイニシエーション作用はもちませんが、長期に渡って体内に貯留し、強力な発がんプロモーターなどの毒性をもち続けることが分かっています。ダイオキシンは発がんプロモーション以外に強力な毒性を示し、奇形誘発作用、免疫機能低下、体重減少(Wasting syndrome), 上皮の過形成、肝毒性、ポルフィリン症などの多彩な毒作用を極微量で引き起こすことが知られています。この毒性が発現するための、最初のトリガーは細胞内に存在するAhRに、リガンドとして結合することで、AhRを介さない毒性発現はあまりないと思われています。 | ||||||||
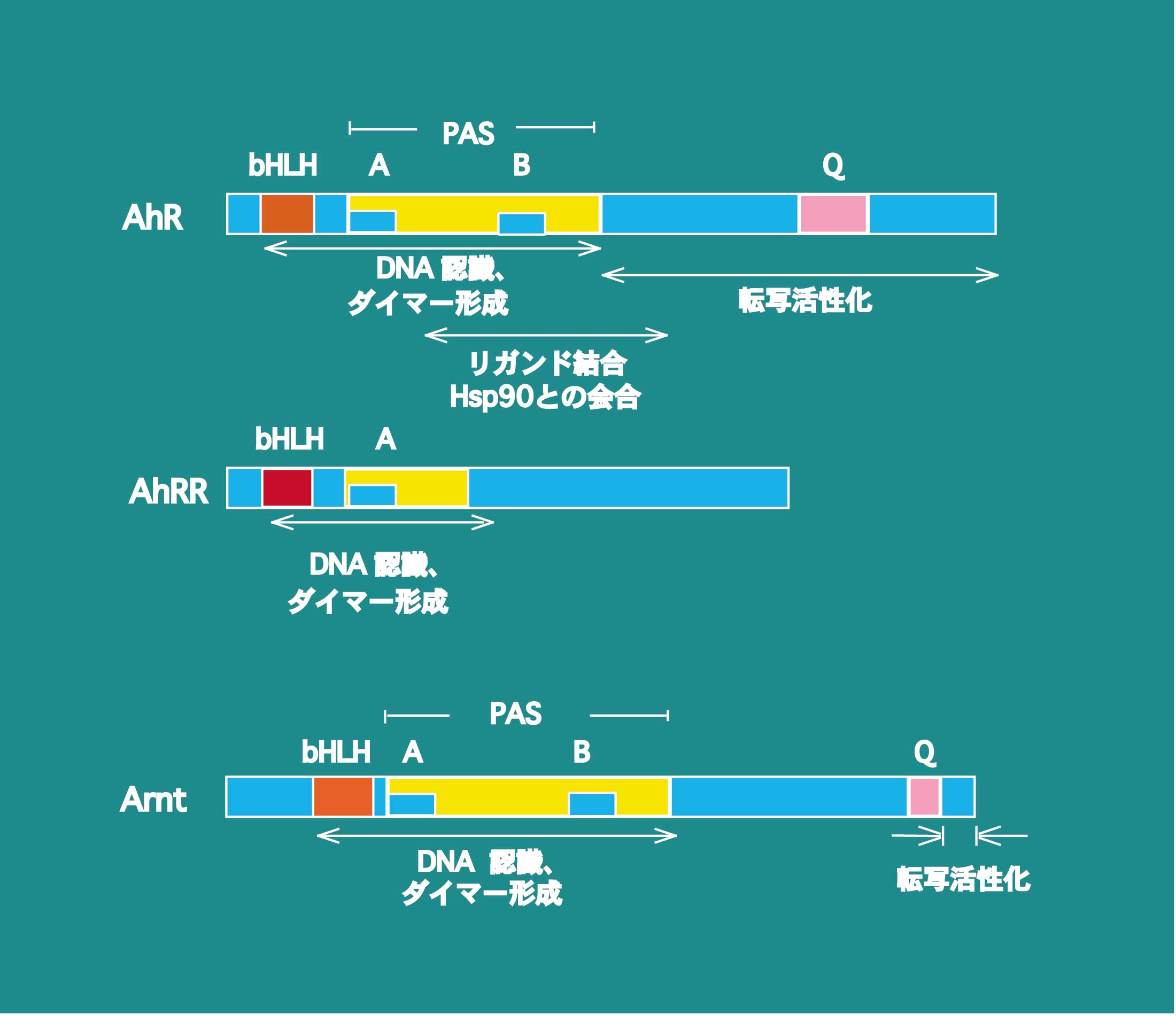
| Ahリセプターの構造 AhRはクローニングによってアミノ酸配列が解明されるまで、作用様式からステロイドホルモンリセプターの仲間と仮定されていました。cDNAクローニングによって、マウスAhRの一次構造が決定された結果、805個のアミノ酸からなり、図に示したように転写因子によく見られるベーシック、ヘリックスーループーヘリックス(bHLH)ドメインのほかに特徴的なPASドメインをもち、ステロイドホルモンリセプターとは全く起源を異にする新しいタイプの受容体型転写因子であることが分かりました。 |
||||||||
 |
||||||||
| bHLHドメインはcMycやMyoDなどの多くの転写因子に見出されたモチーフで、ダイマー形成とDNA結合活性をもっています。260〜300個のアミノ酸からなるPASドメインには、約50アミノ酸からなる繰り返し構造(PAS AとPAS B)が存在します。バクテリアにもPASドメインをもつタンパク質が存在し、ヘムなどの低分子化合物をリガンドにもつものがあり、センサータンパク質として機能しています。それらのタンパク質中のPASドメインはAhRの半分のサイズで、ちょうど繰り返し構造の単位に相当します。AhRのPASドメインは2つのPASドメインからできているといったほうが、正しいのかもしれませんがここでは、従来の考え方で進めます。PAS Bドメインはリガンド結合活性を担っていることが判明し、前半のPAS Aドメインは高等動物のPASドメイン全般がもつタンパク−タンパク相互作用の機能を有し、HLHドメインとともに、あとで述べるようにAhRと同じようにbHLH/PASドメインをもつArntとのヘテロダイマー形成に関与しています。 | ||||||||
| 哺乳類でPASドメインをもつ転写因子は、AhRの他に20種ほどのタンパク質が知られており、低酸素ストレス応答、概日リズム形成、神経の発生などの生理機能に関与しているものがあります。AhRのPASドメインからC末端側は、グルタミンに富む配列が存在し、いわゆる転写活性化領域を形成しています。マウスのAhRにはいくつかの多型が存在し、TCDD感受性が異なることが知られています。TCDD感受性の低いDBA/2マウスのAhRは、高感受性のC57BL/6マウスのAhRより47アミノ酸残基C末端部が延長しています。不思議なことですが、この転写活性化に関与しそうな領域がTCDD感受性の違いに影響していることが分かっています。この違いと、PAS Bドメインに存在するValのAlaへの置換が感受性の低下に関与していることが判明しています。ヒトのAhRはDBA/2マウスと同じアミノ酸残基数であり、TCDDとの結合活性もほぼ同じです。ヒトのAhRにも多型が見出されていますが、マウスのような機能の差はそれほど顕著に存在しないようです。 | ||||||||
| 翻訳後修飾として、AhRもあとで述べますArntもリン酸化されることが報告されています。種々のプロテインキナーゼやそれらの阻害剤を用いた研究などから、リン酸化によって、DNA結合活性が増加するという観察がありましたが、大腸菌で発現したリン酸化されていないAhR-Arntが組織由来のタンパクと同等のDNA結合活性をもつことを考えると、この観察は否定的な気がしています。また、リン酸化をうけるアミノ酸の同定はなされていません。リン酸化によるAhRの生理機能の調節は現在のところ不明といえるのではないでしょうか。タンパク質の安定化や、何らかのシグナル伝達に関与する可能性は否定できませんが、今後の課題といったところでしょうか。その他の、例えばプロリンの水酸化といったような翻訳後修飾はAhRには報告されていません。 | ||||||||
| Ahリセプターの発現と分解 AhRの発現をメッセンジャーRNAレベルでノーザンブロッティング、RT-PCRを使って、また、ウエスタンブロッティングによってタンパクレベルで調べた研究があります。その結果AhRは非常に多く組織で発現していることが分かっています。特に肺、肝臓でAhR mRNAの発現は比較的強く、その他、腎臓、脾臓、心臓、脳、骨格筋などの組織でも弱い発現が認められます。 メチルコランスレン投与によってAhR mRNA量は変化せず、構成的にAhR mRNAは発現しているようです。培養細胞でAhR mRNAの発現量を調べた研究では、細胞によってかなりの差が認められていますが、よくAhRの研究に用いられているマウス肝がん由来のHepa-1細胞では強い発現が観察され、その他多くの培養細胞で発現が認められています。In situハイブリダイゼーション法によって、マウス初期胚でのAhR mRNAの発現を調べた研究では、9.5日胚では、ほとんど発現していませんが、13.5日胚では、ダイオキシンによる奇形が観察される口蓋や、肝臓などの組織で強い発現が観察されています。 |
||||||||
| AhRタンパクはダイオキシンと結合することによって活性化すると、大幅に分解が速められ、Hepa-1細胞での半減期は28時間から3時間に短縮されることが分かっています。この分解メカニズムは、AhRのユビキチン化で、プロテアソーム経路で分解すること、プロテアソ−ムの阻害剤を加えることによってAhRは安定化し、CYP1A1の誘導が増加することが報告されています。 | ||||||||
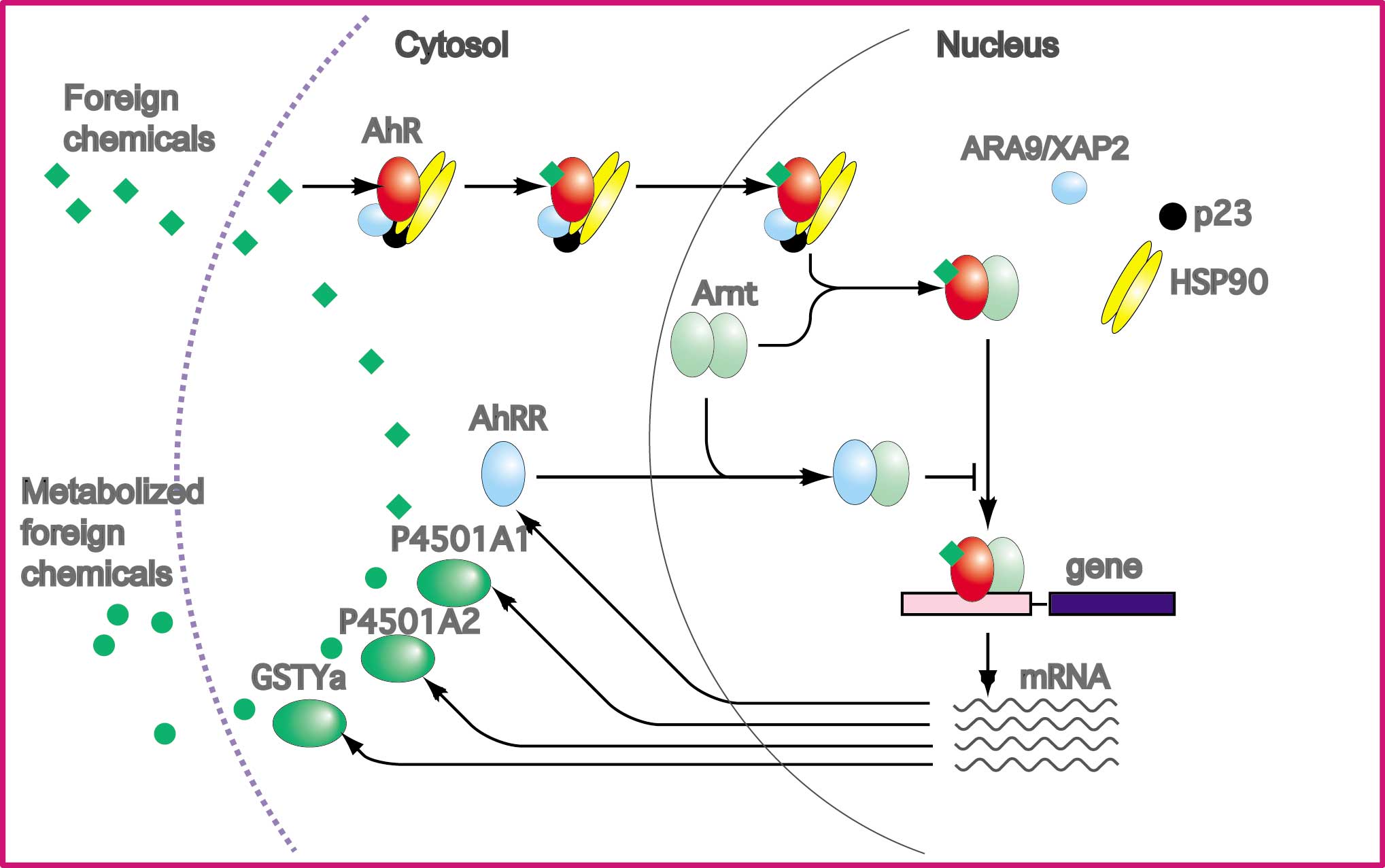
| Ahリセプターの細胞内局在と核移行 ダイオキシンやメチルコランスレンなどのリガンドである誘導物質は脂溶性のため、細胞膜を容易に透過します。通過したダイオキシンは細胞質でHsp90と会合しているAhRにリガンドとして結合します。リガンド結合前の1分子のAhRは2分子のHsp90とかなり大きな9Sの複合体を形成して存在しています。Hsp90との結合に必要なAhRの領域は、PASドメインの後半部のリガンド結合部位とオーバーラップしていて(図参照)、bHLHドメインもその結合に関与しているようです。さらにこの複合体にはXAP2(hepatitis B virus X-associated protein2, ARA9またはAIPとも呼ばれる)と名づけられた分子量37kDaの因子、また、コシャペロンであるp23がこの複合体に含まれています。XAP2はAhR複合体を安定化し、細胞質にとどめる活性が認められていますし、また、p23はリガンド依存性に必要であることが示めされています。AhRの活性化にHsp90は必須であり、酵母を発現系に使った研究では、Hsp90活性を欠損するとAhRは不安定となり、転写活性は発現しないことが報告されています。 |
||||||||
| 分子シャペロンであるHsp90は、AhRがリガンドと結合できるコンフォメーションに保つために必要と考えられていて、リガンドを結合したAhRは、コンフォメーション変化を起こし、Hsp90などとの複合体の状態で核内に移行すると一般に考えられています。ただHsp90との解離が核移行前とする報告もあります。AhRの核移行シグナルは、bHLHドメインよりもN末端側に存在し、核移行に必要な塩基性アミノ酸残基からなるクラスターが、二つの領域に分かれている(bipartite)タイプの核移行シグナルであることが分かっています。 | ||||||||
| 最近AhRにロイシンに富んだ核外移行シグナルがHLHドメインに見出されました。核移行シグナルと核外移行シグナルを併せ持つタンパク質は、一般に核と細胞質を常にシャトルすることが予想され、AhRの場合も核外移行を阻害するレプトマイシンで、AhRの核への蓄積が観察されています。9SのAhR複合体は、ダイナミックに核と細胞質の間を移動しており、今まで種々の細胞や方法で観察されたAhRの細胞内局在は、そのスナップショットであるのかもしれません。Hsp90の解離のタイミング、核膜通過のメカニズムと意味、転写との関係など、AhRの核移行はまだ不明な点が多く、そのメカニズムの解明は今後の課題といっていいでしょう。 | ||||||||
| ArntはHsp90と複合体をせず、細胞質に存在するとされた時期もありましたが、常に核に局在する転写因子であることが現在では確立し、AhRと同じタイプの核移行シグナルがbHLHドメインのN末端側に存在しています。 | ||||||||
| Ahリセプターによる転写活性化 AhRはHsp90と解離した後、Arntとヘテロダイマーを形成し、あとで述べますXREと名づけられた特定のDNA配列に結合します。このヘテロダイマーに転写のコアクティベーターと呼ばれる転写因子が結合し、RNAポリメラーゼを含む一般的な転写開始複合体をリクルートすると考えられています。AhRの転写活性化ドメインはPASドメインよりもC末端側の広範な領域に渡って、複数個存在することが示されています。転写活性化ドメインを認識し、転写開始複合体にその活性を伝達する因子として、すでにステロイドホルモンリセプタ−の転写活性化において見出された、Src-1, NCoA-2, p/CIPがAhRに対するコアクティベーターとして見出されました。細かい話で恐縮ですがSrc-1はリガンドとの結合依存的に、AhR, Arntと結合する報告があります。NCoA-2, p/CIPともAhRは結合しますが、Src-1との関係はどうなっているのか、またArntはSrc-1, NCoA-2とは直接結合しますが、p/CIPとは結合しないようです。 |
||||||||
| また、やはり、ステロイドホルモンリセプタ−の転写活性化に関与するRIP140が、AhRのコアクティベーターとして機能することが報告されています。RIP140はAhRの転写活性化領域の一つである、グルタミンに富んだ領域と結合するようです。RIP140はエストロゲンリセプタ−の転写活性化にも関与しますが、エストロゲンリセプタ−の場合は、リガンドであるエストロゲンに依存して、その結合が起きると報告されていますが、AhRの場合は、リガンドの存在に関係なくAhRとRIP140は結合するようであります。また、コアクティベーターと核内受容体との結合に見出されたLXXLLモチーフがRIP140に存在し、エストロゲンリセプタ−との結合に関与しているのですが、AhRとの結合にはこのモチーフは関与なく、異なった部位に結合活性が存在していると報告されています。ArntのC末端部にも強い転写活性化ドメインが存在します。この転写活性化ドメインはAhRの転写活性化ドメインに比べて短く、たった34アミノ酸残基しかありませんが、このドメインにはCBP/p300が結合し、転写を活性化することが報告されています。 | ||||||||
| このように、いくつかのコアクティベーターが、AhR-Arnt複合体の転写活性化を伝える因子として報告されています。ただ、あまり知識が整理されていなくて、自分で書いていても混乱してきます。AhR-Arnt複合体に特異的な因子は、現在のところ見出されていません。ステロイドホルモンリセプタ−の転写活性化に使われる共通の因子が多いようです。また、これらの因子がすべて、同時に働いているのか、何らかの調節機構が存在するのかは分かっていません。 | ||||||||
| AhRによって活性化される遺伝子 メチルコランスレンで誘導される遺伝子の転写調節領域が調べられた結果、その誘導に直接関係するエンハンサーが同定され、Xenobiotic Responsive Element (XRE、DREとも呼ばれる)と名づけられ、CACGCという共通のコア配列をもつことが判明しました。その後、AhRとArntのヘテロダイマーが、直接それらのbHLHのベーシック配列によって認識し結合することが分かりました。このうちCACハーフサイトがArntによって認識され、GCハーフサイトが、AhRによって認識されるということも分かっています。 |
||||||||
| AhR-ArntのXREに対する解離定数が種々の材料から抽出したヘテロダイマーで調べられた結果、数nM のオーダーであることが報告されています。Arntはホモダイマーを形成し、CACGTGという対称的なEボックスにも結合することができます。 | ||||||||
| コア配列中にあるCpG配列は哺乳類の細胞ではメチル化を受けることが知られていますが、メチル化によってその結合は、著しく低下することが報告されています。遺伝子の誘導に関与するXREが、メチル化された場合、その誘導活性はきわめて低くなり、実際上単独ではないと考えてもよいと思われます。 | ||||||||
| XREは強く誘導されるP4501A1遺伝子上流に少なくとも6ヶ所存在するほか、TCDDで誘導されるP4501B1、グルタチオン-S-トランスフェラーゼ、キノンレダクターゼ、UDP-グルクロノシルトランスフェラーゼなどの一連のメチルコランスレン誘導型薬物代謝酵素遺伝子上流に見いだされています。 | ||||||||
| メチルコランスレンの全解毒過程に関与する、第1相と第2相の薬物代謝酵素が、それらの遺伝子上流のXRE配列を介して、基質であるメチルコランスレンなどによって同時に誘導されることは、プリミティブな遺伝子発現の様式の一つと考えられます。最初にいいましたように、毒性の強いダイオキシン、ジベンゾフラン、ポリ塩化ビフェニルはこれらの誘導酵素によって代謝されません。 | ||||||||
| これらの遺伝子のプロモーターには、Sp1ファミリーの結合部位であるGCボックスが、プロモーターのエレメントとして共通して含まれています。AhR, ArntヘテロダイマーとSp1の間には、タンパクータンパク相互作用が存在し、これによってDNAのコンフォメーションが変化し、相乗的に転写を活性化することが示されています。 | ||||||||
| また薬物代謝酵素以外にも同じメカニズムで誘導される遺伝子が知られています。サイトカインの一種であるインターロイキン1や細胞周期に働いているp27Kip1がTCDDによって誘導されることが報告されました。これらは細胞の増殖や分化に関係する遺伝子群であって、ダイオキシンの毒性に関係していると考えられ注目されています。AhRの解毒に関した機能以外の他の機能と関係しているのでしょう。 | ||||||||
| AhRのノックアウトマウスが作製されています。AhR欠損マウスでは、当然といえば当然ですがP4501A1やP4501A2のメチルコランスレンなどによる誘導的発現は観察されません。そのほかには、肝臓の重量が、少し小さいことを除いて、表面上の異常は観察されませんでした。 | ||||||||
| このAhR欠損マウスを使って、ダイオキシンのマウス胎仔に対する毒性が調べられています。マウスではダイオキシンはおもに二種の奇形を引き起こすことが分かっています。一つは上顎部の融合が不完全となる口蓋裂で、もう一つは水腎症です。12.5日胚にダイオキシンを経口投与し、この二つの奇形発生を調べたところ、野生型のマウスでは、100 %奇形が発生したのも関わらず、AhR欠損マウスでは、まったくこれらの奇形は発生しませんでした。この結果は、TCDDの胎仔毒性はAhRを介して発生することを端的に示していると考えられます。薬物代謝に関する遺伝子の活性化では、このような奇形が発生するとは考えにくいので、どのような遺伝子の活性化が関与するのか、あるいは転写活性化によらない未知のAhRの作用によって、これらの奇形が生じるのか興味ある問題ですが、分かっていないのが現状です。 | ||||||||
| Ahリセプターのフィードバック制御 AhRに類似の一次構造をもった転写因子がクローニングされています(図参照)。Ahリセプターリプレッサー (AhRR) と名づけられたこの因子は、bHLHドメインとPAS Aドメインが、AhRと高度に類似していて、Arntとヘテロダイマーを形成することができ、XREに結合することができました。また、PAS Bドメインがなく、さらにC末端側のアミノ酸配列はAhRと全く異なっていました。また、Hsp90と相互作用せず、核に局在するタンパクであることが分かりました。厳密な証明はまだなされていませんが、ダイオキシンを始めとするリガンドに対する結合活性はないと考えられています。さらに、C末端側の領域は転写抑制作用を示しました。これらの結果を総合して考えると、AhRRはAhRと競合的にArntと結合し、さらにXRE結合もAhRと競合すると思われます。このようにしてAhRの転写活性を抑え、PASドメインのC末端側に存在する転写抑制領域で、下流の遺伝子の活性化を抑制すると考えられます。さらに興味深いことに、AhRR遺伝子が単離され、遺伝子上流領域が解析された結果、3個のXREが見いだされたことです。これはAhRRがAhRの下流に存在する遺伝子の1つであることを意味しています。実際、メチルコランスレンをマウスへ投与したところ、種々の組織でAhRR mRNAが誘導が観察されています。これらの結果からAhRRがAhRによる遺伝子活性化機構に深く関与し、負のフィードバックループを作っていることを示しているように思われます。ただ、AhRRが存在していてもAhRは減少しない場合があり、もう少し研究が必要と思われます。図に今まで述べてきました、外来異物による転写活性化メカニズムをまとめました。 |
||||||||
 |
||||||||
| AhRは魚類から上位の脊椎動物に存在するとされていましたが、ショウジョウバエや線虫にも分子進化上起源を同一にする、AhR類似タンパク質があることがわかっています。しかし、これらの種のAhRホモローグはリガンド結合活性をもたないようです。AhRを中心とした外来異物代謝系の進化は、脊椎動物において発生したと考えられます。AhRの下流の遺伝子を見ると、薬物代謝の酵素など以外に、細胞の増殖や分化に関与するタンパク質が含まれていることに気がつきます。これらを活性化する機能は、解毒に関与しない昆虫や線虫のAhRの機能と似ているのかも知れません。増殖や分化にAhRが関与するのなら、どのような内在性のリガンドが働いているのでしょうか、または、それらを必要としないメカニズムが存在するのでしょうか、今後の大きな課題と考えています。また、ダイオキシンの毒性がどのような遺伝子の活性化によっておきるのでしょうか、遺伝子活性化以外にダイオキシンの毒性が発揮するメカニズムは存在するのでしょうか、これらの疑問は今後解決しなければならない問題と考えられます。 | ||||||||